Карцином in situ на щитовидна и други ендокринни жлези МКБ D09.3
В МКБ D09.3 Карцином in situ на щитовидна и други ендокринни жлези се разглеждат предраковите изменения (карциноми in situ) на различни ендокринни жлези:
- щитовидна жлеза
- околощитовидни жлези
- хипофизна жлеза
- епифиза
- надбъбречна жлеза.
КАРЦИНОМ IN SITU НА ЩИТОВИДНАТА ЖЛЕЗА
Карциномът in situ на щитовидната жлеза се означава още като неопластична С-клетъчна хиперплазия или медуларен карцином in situ.
С-клетъчната хиперплазия е прекурсор на наследствената форма на медуларния карцином. С-клетъчната хиперплазия на щитовидната жлеза е описана в началото на 70-те години като лезия, свързана с фамилния медуларен карцином на щитовидната жлеза и множествената ендокринна неоплазия (MEN) тип II и IIB.
Анатомия
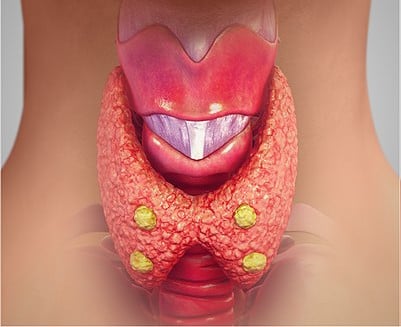
Щитовидната жлеза - glandula thyroidea - е най-голямата ендокринна жлеза. Съставена е от два дяла (лобове) — ляв и десен. Те са свързани помежду си с провлак — истмус. Щитовидната жлеза е обвита с тънка капсула — capsula fibrosa, която изпраща в дълбочина гредички и преградки, разделящи жлезния паренхим на делчета.
Фоликулът е основната структурна единица на щитовидната жлеза. Фоликулите имат неправилно сферична форма и показват значително разнообразие в големината си. Всеки фоликул се изгражда от един ред клетки, които залягат върху нежна базална мембрана. Вътрешността им е изпълнена с желеподобно вещество — колоид. Отвън към фоликула заляга гъста мрежа от лимфни и кръвоносни капиляри.
Подробно описание на анатомичното устройство на щитовидната жлеза ще намерите в:
» Анатомия на щитовидна жлеза (glandula thyroidea)
Морфология
Две различни клетъчни популации могат да бъдат намерени в паренхима на щитовидната жлеза — фоликуларни клетки, които произлизат от ендодермата, най-многобройни са и синтезират тиреоглобулин, и С-клетки — малка клетъчна популация, известни в миналото като парафоликуларни клетки, различаващи се значително по произход, морфологична характеристика и функции от първия вид. С-клетките са описани за първи път при животни (плъхове и кучета).
При човека са описани през 1966 от Pearse, използвайки оцветяване със сребро. Той предположил, че тези клетки съдържат калцитонин (calcitonin) и затова ги нарекъл С-клетки. Откритието му е потвърдено чрез развитието на имунохистохимията и чрез анти-калцитонин антитялото, което показва наличието на този хормон в цитоплазмата на С-клетките.
По това време е доказано, че медуларния карцином (отделна форма на карцином на щитовидната жлеза, описана от Hazard) се състои от С-клетки.
С-клетките се развиват от един срединен и два странични примордиума (в ембриологията се определя като орган или тъкан, които са в най-ранно разпознаваемия им етап на развитие). Срединният примордиум произлиза от ендодермата. Страничните примордиуми произлизат от ултимофарингеалните тела (ембрионални структури, от които произлизат клетките, произвеждащи калцитонин - С-клетките).
Смята се, че допълнителен източник на С-клетки може да бъде стволова ендодермална клетка, която може да се диференцира до фоликуларна или до С-клетка.
С-клетките са много малко на брой — само 0,1% от масата на щитовидната жлеза и са разположени на границата между средните и горните трети на страничните лобове. Присъствието на такива клетки в долната трета на жлезния лоб или в истмуса е много рядко или съмнително.
В непроменената жлеза С-клетките имат интрафоликуларна позиция и са разположени поединично или в малки групи между базалната мембрана и фоликуларните клетки, така че те не са контакт с колоид.
Чрез електронна микроскопия е доказано наличието на два основни вида секреторни гранули в С-клетките, като и двата вида съдържат калцитонин, което се установява с имунохистохимия.
Идентификацията на С-клетките чрез оцветяване с хематоксилин и еозин (ХЕ) е много трудно и съмнително. Те се проявяват като многоъгълни или вретеновидни клетки с бледо оцветяване, два или три пъти по-големи от фоликуларните клетки. Цитоплазмата им е фино гранулирана, а ядрата са кръгли или овални, с видно ядърце.
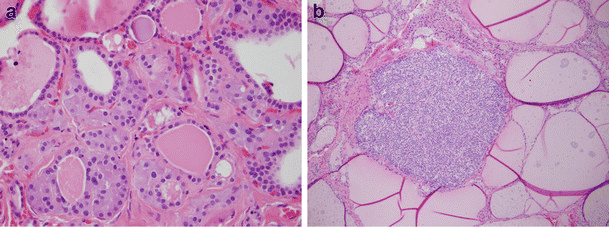
Изображение: www.researchgate.net
При хистохимичен анализ С-клетките показват отличителните белези на дифузната ендокринна клетъчна система на Feyerter, като най-важен от тях е аргирофилията (тъканите се оцветяват от сребърни соли), открита чрез оцветяване по Grimelius.
Широко използван в миналото, сега оцветяването по Grimelius е заменено от имунохистохимия, която е най-прецизният и опростен метод за определяне на С-клетките. При имунохистохимичните техники С-клетките са положителни за невроендокринни маркери като хромогранин А, синаптофизин и неврон-специфична енолаза, но най-специфичен маркер е техният основен хормонален продукт — калцитонин.
Калцитонинът, основният продукт на С-клетките, представлява пептиден хормон, който намалява концентрацията на калций в кръвта чрез потискане активността на остеокластите в костите.
Подробна информация за изследването на калцитонин можете да намерите в статията:
Точният брой на С-клетките е неизвестен и поради тази причина е трудно да се диагностицира истинска хиперплазия. Трудностите при определяне на точния брой на С-клетките са резултат от техните големи различия в зависимост от възраст, пол, метод за вземане на проба и свързаната с тях патология на щитовидната жлеза.
Етиология
Етиологията на фамилния медуларен карцином е свързана с герминативна (наследствена) мутация на RET гена, като е открита точкова мутация в почти всички индивиди с клинични, патологични и/или анамнестични данни за наследствено заболяване. Точната причина за герминативните мутации е неизвестна.
Най-широко приетата дефиниция за С-клетъчна хиперплазия включва наличието в поне една област от жлезата, където има най-много С-клетки, на повече от 50 имунооцветени С-клетки на поле с ниско увеличение (х 100) в двата лоба на щитовидната жлеза.
Морфологично, С-клетъчните хиперплазии се разграничават по начина на растеж на С-клетките във фоликула и морфологията на С-клетките. С-клетъчната хиперплазия варира от дифузно увеличени клетки до възли от С-клетки, които в крайна сметка заменят тироидните фоликули така, че те остават лишени от колоид. Когато веднъж базалната мембрана на фоликула е нарушена, диагнозата е медуларен карцином.
С-клетъчната хиперплазия показва дифузна и интензивна имунореактивност за калцитонин, по-голяма от тази за медуларен карцином. Хиперплазиите в областта на щитовидната жлеза могат да бъдат отговор към променени циркулиращи имуноглобулини, които повлияват и се свързват с TSH рецепторен комплекс (както е при автоимунен хипертиреоидизъм) или по-рядко като отговор на излишък на TSH от хипофизата поради хипофизна дисфункция или неоплазия. Могат да бъдат и вторичен отговор на щитовидната жлеза към повишените нива на TSH от хипофизата, причина за което е намалената продукция на тироидни хормони (вродена грешка на щитовидния метаболизъм).
Патоанатомия
От патологична гледна точка, карциномите in situ на щитовидната жлеза представляват натрупване на различни генетични прояви — от нормален епител до напълно злокачествено изменен. Тези генетични особености се проявяват под микроскоп като по-силно изразена цитологична атипия, ядрена анаплазия (загуба на структурна диференциация в клетка или група от клетки), лесно идентифицирана митотична (митоза - вид клетъчно делене) активност, анормални митотични фигури, а от време на време и некроза (локална смърт на клетки). Появяват се и промени в кръвоснабдяването, т.нар. ангиогенеза (формиране на нови кръвоносни съдове).
Патологично, С-клетъчната хиперплазия във фамилната характеристика на наследствения автозомно-доминантен процес, се открива най-често в горните две трети на щитовидната жлеза, в латералните лобове. При фамилно свързаната С-клетъчна хиперплазия могат да бъдат намерени С-клетки в други области на жлезата, а рядко и в истмуса й. При тези условия доказателствата за С-клетъчна хиперплазия са свързани с повишени нива на серумния калцитонин по принцип или след стимулация с пентагастрин или калций. Понякога цитологичните особености на С-клетките са свързани с атипия, включително и ядрен атипизъм.
Класификация
Според начина на растеж на клетките
Различават се три вида С-клетъчни хиперплазии в зависимост на начина на растеж на клетките:
- фокална (огнищна) С-клетъчна хиперплазия;
- дифузна С-клетъчна хиперплазия;
- нодуларна С-клетъчна хиперплазия;
Морфологичните особености на С-клетките определят особена форма на С-клетъчна хиперплазия — неопластична С-клетъчна хиперплазия.
С-клетките при този вид хиперплазия имат лека до умерена клетъчна атипия; ядрен плеоморфизъм (способност да се прояви в повече от една форма), подобен на този при инвазивен медуларен карцином, а най-често имат нодуларен модел на растеж, следователно се различават морфологично от фоликуларните клетки и се разпознават при рутинно оцветяване с хематоксилин и еозин.
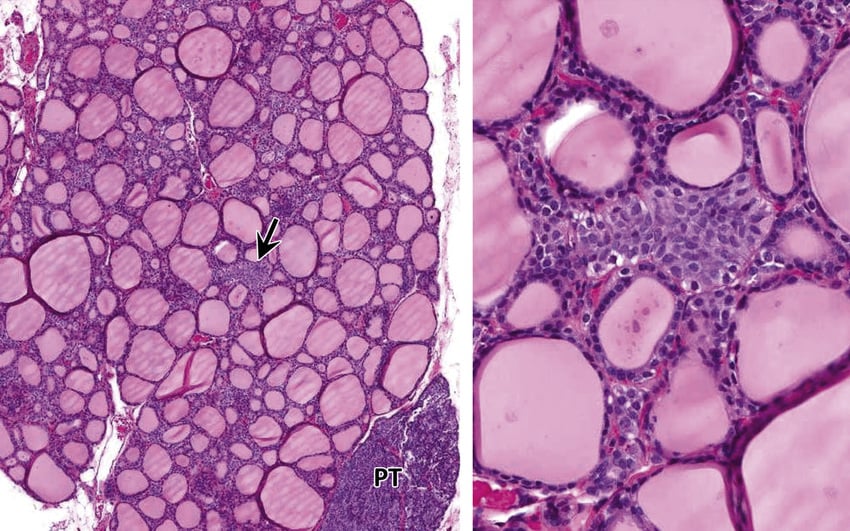
Изображение: www.researchgate.net
Според молекулярните особености на С-клетките
Според молекулярните особености на С-клетките (RET-протоонкогенен анализ) се различават два типа С-клетъчна хиперплазия:
- физиологична или реактивна С-клетъчна хиперплазия;
- неопластична С-клетъчна хиперплазия;
Основните характеристики на физиологичната С-клетъчна хиперплазия включват:
- фокален (огнищен) или дифузен, рядко нодуларен, модел на растеж;
- хиперпластичните С — клетки са неразличими от съседни фоликуларни клетки при рутинно оцветяване с хематоксилин и еозин;
- липсва герминативна мутация в RET-протоонкогена, както няма фамилна анамнеза за медуларен карцином на щитовидната жлеза и MEN 2A синдром;
- възможно е леко до умерено повишаване на серумните нива на калцитонин с или без стимулация с пентагастрин;
Неопластичната С-клетъчна хиперплазия, наричана още медуларен карцином in situ на щитовидната жлеза, има значително различни морфологични, генетични и кинетични характеристики в сравнение с физиологичната хиперплазия, в съответствие със злокачествената С-клетъчна лезия. Основните особености са:
- неопластичната хиперплазия е видима при микроскопско изследване с рутинно оцветяване — неопластичните С-клетки са по-големи от нормалните и са леко до умерено атипични, подобни на тези при инвазивен медуларен карцином;
- възлест и дифузен модел на растеж, често двустранно;
- връзка с герминативна мутация на RET-протоонкогена. Най-честите мутации са открити в екзони 10, 11, 13, 14, 15 и 16, а рядко и в 18;
- наличие на отделна базална мембрана около хиперпластичните възли, която може да се визуализира чрез оцветяване по Schiff или чрез имунооцветяване с анти-колаген IV антитела. Тези техники на оцветяване помагат за диференцирането на неопластична С-клетъчна хиперплазия от ранен инвазивен микромедуларен карцином на щитовидната жлеза, който се характеризира с преминаване на С-клетки през дефектни зони и/или редупликации (удвояване) на базалната мембрана;
Генетично определеният медуларен карцином на щитовидната жлеза се предхожда и придружава от С-клетъчна хиперплазия, която се счита за прекурсор на заболяването, както при мъже, така и при жени.
Диагноза
Заболяването може да се диагностицира предоперативно при асимптоматични деца и юноши чрез откриване на герминативна мутация на RET-протоонкогена, дори и да няма повишаване на серумните нива на калцитонин. При тези млади пациенти неопластичната С-клетъчна хиперплазия може да бъда само патологичен белег, представляващ пренеопластичен етап на медуларен карцином. Когато туморите вече са се развили, те най-често са мултифокални (група от отделни тумори се развиват независимо един от друг, но не са се отделили от основния тумор, подобно на метастазите) и двустранни и винаги са придружени от медуларен карцином in situ.

Изображение: www.freepik.com
Молекулярният анализ на RET-мутациите се извършва чрез взимане на периферна кръв, като основно се анализират екзони 10, 11, 13, 14, 15 и 16. Когато мястото на мутацията е известно поради изследване на други членове на семейството, препоръчва се извършването на молекулярни тестове, насочени към специфични региони.
Генетичният скрининг за RET-герминативни мутации е важен за членовете на семейства, за които се знае, че са засегнати от наследствен медуларен карцином, както и за роднини от първа степен на индивиди, при които е открит медуларен карцином и RET-герминативна мутация.
Поставянето на диагнозата включва и цитологично изследване.
След като медуларния карцином еволюира от С-клетъчна хиперплазия, стимулът за растеж може да изчезне — или от размера на тумора, или от произведените по-високи нива на калцитонин.
Когато се прави сравнение на съпътстващата С-клетъчна хиперплазияпри спорадични и наследствени случаи, е установено, че хиперплазията при спорадичните случаи е по-честа при мъжете и е най-често с реактивен модел на растеж и рядко с неопластичен.
Описани са случаи на ранна инвазия (медуларен микрокарцином) при много млади пациенти с фамилна С-клетъчна хиперплазия, като някои от тези ранни карциноми са способни да метастазират.
Патолозите откриват трудности при определянето на долната граница на медуларен карцином, който е микроинвазивен медуларен карцином на щитовидната жлеза, и на горната граница на С-клетъчната хиперплазия/С-клетъчна неоплазия.
Диференциална диагноза
Диференциалната диагноза на С-клетъчната хиперплазия се прави с:
- медуларен микрокарцином
- метастазирал медуларен карцином
- плътни клетъчни гнезда
- фокална сквамозна метаплазия
- тиреоидит (възпаление на щитовидната жлеза)
Разграничаването на С-клетъчна хиперплазия от ранна форма на медуларен микрокарцином е трудно. Основните критерии включват клетки, преминаващи през базалната мембрана на фоликула и разпространяващи се към околната строма. Появата на фиброза около гнездата от туморни клетки подсказва за инвазия.
Изображение: www.freepik.com
Лечение
При пациентите с клинично доказан тумор обикновено се прилага тотална тиреоидектомия (премахване на цялата щитовидна жлеза) и резекция на шийните лимфни възли.
Постоперативната терапия включва външна радиационна терапия, аблация с йод-131, конвенционална химиотерапия, прилагане на соматостатинови аналози, анти-CEA (СЕА=карциноембрионален антиген) радиоимунотерапия, радиочестотна терапия, както и насочена молекулярна терапия.
КАРЦИНОМ IN SITU НА ОКОЛОЩИТОВИДНИТЕ ЖЛЕЗИ
Карциномът in situ на околощитовидните жлези е рядко злокачествено заболяване. Тези тумори обикновено предизвикват отделянето на паратхормон, което води до хиперпаратиреоидизъм. Може да има съмнение за карцином in situ, но обикновено не може да се потвърди преди операция, което усложнява стратегията за лечение.
Анатомия
Околощитовидните (паращитовидните) жлези - glandulae parathyroideae - в повечето от случаите наброяват четири отделни телца (две горни и две долни), които са разположени върху задната повърхност на страничните лобове (дялове) на щитовидната жлеза. Заобиколени са от хлабава съединителна тъкан и се прикрепят към капсулата на щитовидната жлеза. Като форма те са приплеснати и удължени — дължината им възлиза на около 6 мм, ширината — на 3-4 мм, а дебелината — на 2-3 мм.
Хормонът на паращитовидните жлези се нарича паращитовиден хормон, паратхормон или паратирин.
Изображение: https://www.scientificanimations.com, CC BY-SA 4.0, via Wikimedia Commons
Подробно описание на анатомичната структура на околощитовидните жлези ще намерите тук:
» Анатомия на околощитовидни жлези (glandulae parathyroideae)
Епидемиология
Карциномите на околощитовидните жлези се срещат изключително рядко — приблизително 2 случая на 10 млн. пациенти за година, като се засягат обикновено пациенти над 30-годишна възраст.
Етиология
Етиологията на карциномите in situ е неизвестна в повечето случаи. Заболяването може да бъде свързано с генетично заболяване или с анамнеза за облъчване в областта на врата. HRPT2 гена кодира протеин, наречен парафибромин. Смята се, че повечето паращитовидни карциноми показват липса на експресия на този протеин. Свръхекспресията на циклин D1 протеина (Cyclin D1) също е свързана с паратиреоиден карцином. Мутации в MEN1 гена могат да са причина за развитие на заболяването.
Карциномите на околощитовидните жлези причиняват хиперпаратиреоидизъм, но могат да се наблюдават и редки случаи на нефункциониращ паращитовиден хормон. Хиперпаратиреоидизмът е резултат от свръхпроизводство на паратхормон, като в повечето случаи свръхпродукцията на хормон се причинява от единичен доброкачествен аденом (около 85%). По-голямата част от останалите случаи са причинени от хиперплазия на околощитовидните жлези или множествени аденоми. За по-малко от 1% от случаите на хиперпаратиреоидизъм, етиологията е паратиреоиден карцином.
Рядко, ракът на околощитовидните жлези може да бъде нефункционален, което означава, че може да има злокачествени изменения, но няма производство на паратирин и съответно хиперпаратиреоидизъм.
Диагноза
Диагнозата често не се прави преди паратиреоидектомия (премахване на една или няколко околощитовидни жлези). Това води до неадекватна туморна ексцизия (изрязване) и склонност към локален рецидив (повторно развитие на заболяването). Рецидивите могат да бъдат лекувани чрез локална ексцизия или аблационни лечения като радиочестотна аблация.
Анамнезата трябва да е насочена към симптомите на хиперкалциемия плюс другите симптоми на хиперпаратиреоидизъм.
Основните симптоми са:
- болка в костите, патологична фрактура или друго доказателство за костно заболяване (приблизително в 90% от пациентите);
- бъбречни камъни (50-80% от пациентите);
- симптоми на хиперкалциемия — изтощение, слабост, обърканост, депресия, запек;
Диагнозата се поставя с помощта на различни методи:
Лабораторни изследвания
Определят нивата на калция и паратхормона в кръвта, които се повишават при карцином;
 Изображение: www.freepik.com
Изображение: www.freepik.com
Образна диагностика
Методите за образна диагностика включват:
В момента няма на разположение предоперативен тест, който да помогне за надеждното разграничаване на паратиреоиден карцином in situ от доброкачествен първичен хиперпаратиреоидизъм.
Хистология
Диагнозата се основава на хистологичната характеристика на изрязаната околощитовидна жлеза и клинични показатели като рецидив или метастази.
Карциномите обикновено са капсулирани и често имат фиброзна преграда в самата жлеза. Паренхимът на тумора обикновено се състои предимно от основните клетки на жлезата, които обикновено са по-големи от тези, които се наблюдават в аденоми и имат характерен цитологичен вид. Наблюдават се различни степени на ядрен атипизъм, както и митотични фигури.
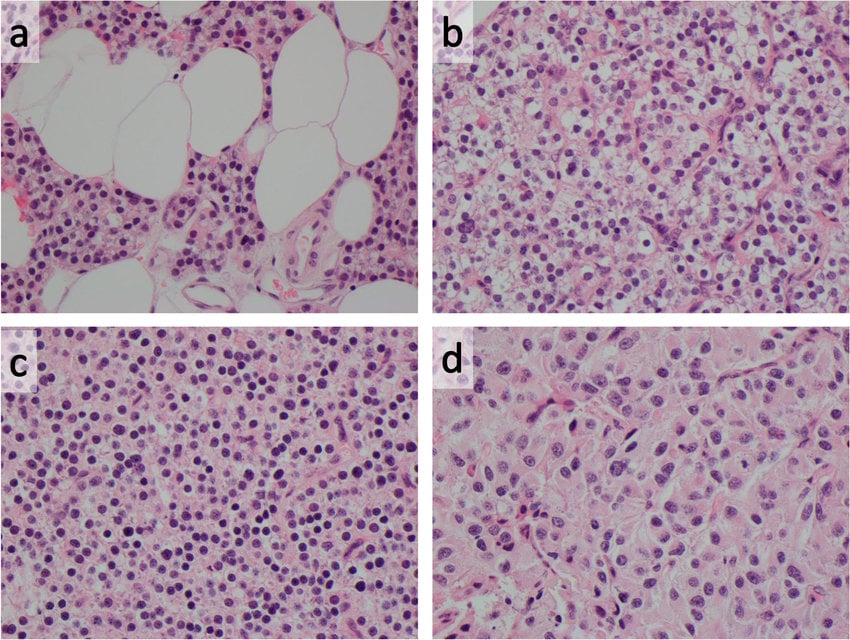
Изображение: www.researchgate.net
Молекулярни или генетични маркери могат да се окажат полезни при разграничаване на паращитовиден карцином от други лезии. Продуктът на HRPT2 гена — парафибромин — се среща често, но невинаги. Увеличената експресия на друг маркер — PGP9.5 (Protein Gene Protein 9.5) — също е много специфична за паратиреоиден карцином.
Лечение
Без лечение, карциномът in situ на паращитовидните жлези води до тежки симптоми на хиперпаратиреоидизъм и може да доведе до камъни в бъбреците, нефрокалциноза (отлагане на калциеви соли в бъбреците), патологични фрактури и невропсихични симптоми.
Медикаментозна терапия
Не е известна ефективна медикаментозна терапия за паратиреоиден карцином in situ.
Лечението е насочено предимно към контролирането на хиперкалциемията, която често е доста тежка, като лечението е подобно на това при хиперкалциемия, причинена от други фактори.
Следващата стъпка при хронично лечение е използването на бисфосфонати.
Хиперкалциемията, причинена от паратиреоиден карцином, често е резистентна към дългосрочно медицинско лечение.
Оперативно лечение
Оперативната интервенция — резекцията (изрязване, отрязване) на паратиреоидния рак е единственото ефективно лечение, засега.
КАРЦИНОМ IN SITU НА ХИПОФИЗАТА
Характерен белег на карциномите на хипофизната жлеза са далечните метастази, независимо дали се проявяват системно чрез хематогенен (кръвен) път на разпространение или в рамките на черепната кухина, заедно с гръбначномозъчните пътища.
Анатомия
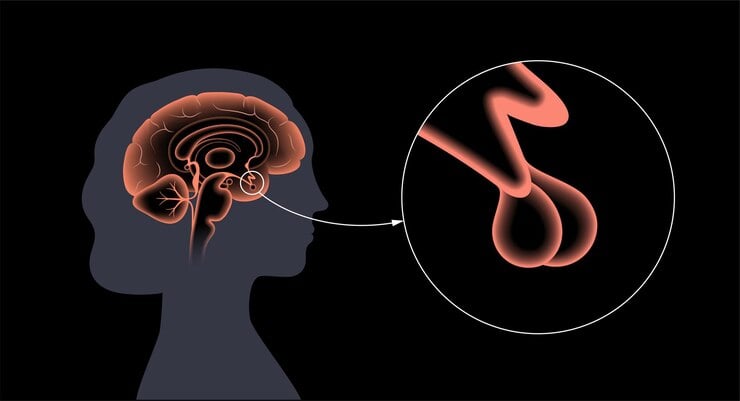
Хипофизната жлеза - hypophysis (glandula pituitaria) - представлява нечифтно тяло, което се разполага в хипофизната ямка на sella turcica (турско седло) в основата на мозъка, а над тази ямка се разполага твърдата мозъчна обвивка. Жлезата се изолира от костната стена чрез дебел и плътен слой от съединителна тъкан.
Хипофизната жлеза е с овална форма и е приплесната в предно — задно и горно — долно направление.
Целият паренхим на жлезата е разделен на две части: предна (аденохипофиза) и задна (неврохипофиза) част. Тези части се различават по произход, топография и функции.
Изображение: www.freepik.com
Аденохипофизата произвежда шест хормона:
- растежен хормон
- пролактин
- адренокортикотропен хормон — АКТХ
- тиреостимулиращ хормон — TSH
- фоликулстимулиращ хормон — FSH.
Хормоните на задната хипофиза са:
- антидиуретичен хормон
- окситоцин
Подробна информация за хипофизната жлеза ще намерите в:
» Анатомия на хипофизна жлеза (glandula pituitaria)
Епидемиология
 Туморите на хипофизната жлеза и селарната област (около sella turcica) представляват около 10-15% от всички мозъчни тумори, като по-голямата част са аденоми.
Туморите на хипофизната жлеза и селарната област (около sella turcica) представляват около 10-15% от всички мозъчни тумори, като по-голямата част са аденоми.
Хипофизните карциноми са много редки, като представляват по-малко от 1% от всички неоплазми на хипофизата. По-голямата част са ендокринно активни тумори: най-често срещаните са пролактин — секретиращите тумори, следвани от АКТХ-секретиращи тумори. Неактивните тумори съставляват около 15-20% от случаите.
Изображение: www.freepik.com
Етиология
Не съществува конкретна причина за развитието на хипофизните карциноми in situ. Някои от тях може да бъдат причинени от стимулация на хипоталамуса — частта от мозъка, която сигнализира на хипофизната жлеза да произвежда хормони.
Хората, които имат редки наследствени състояния като множествена ендокринна неоплазия тип 1 (MEN-1) — заболяване, което предизвиква тумори в жлезите на ендокринната система (отделящи хормони в кръвния ток) и в началната част на тънките черва, или Carney комплекс — заболяване, което причинява няколко типа тумори, включително в хипофизната жлеза, имат по-висок риск за развитие на злокачествени заболявания на хипофизата. Около 1-5% от хипофизните тумори се наблюдават в рамките на семейството.
Патогенеза
Патогенезата на хипофизните карциноми е неясна, а имунохистохимичните маркери, чрез които става хистологичното разграничаване на карциномите in situ на хипофизната жлеза от доброкачествените новообразувания, не дават достатъчно информация.
Класификация
През 2000 година Световната здравна организация (СЗО) създава класификация, която подпомага трудното идентифициране на туморите с увеличен потенциал за анапластично (намаляване на клетъчната диференциация) преобразуване, като създава междинна класификация на атипичните хипофизни аденоми. Тези тумори се характеризират с увеличена пролиферативна активност (Ki-67>3%), както и свръхекспресия на протеин p53 (tumor protein p53).
Клинична картина
Клиничното протичане при карциномите in situ на хипофизата е асимптоматично.
Туморите обаче могат да променят нивата на секретираните хормони, като водят до повишени или намалени нива на даден хормон/и. Злокачествено развитие може да се диагностицира само когато има доказани метастази в или извън нервната система.
Диагноза
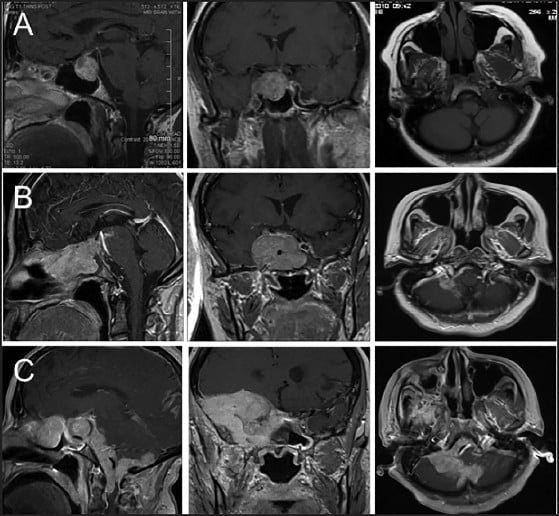 Диагнозата на хипофизните карциноми се поставя чрез клинични и образни методи за изследване, докато диагнозата "карцином in situ" не е възможна.
Диагнозата на хипофизните карциноми се поставя чрез клинични и образни методи за изследване, докато диагнозата "карцином in situ" не е възможна.
Изследванията, които се провеждат, включват кръвни тестове — ако нивата на хипофизните хормони в кръвта са високи, тогава на помощ идват методите за образна диагностика — компютърната томография (КТ) или магнитен резонанс (MRI).
Изображение: www.endocrinepractice.org
Хистология
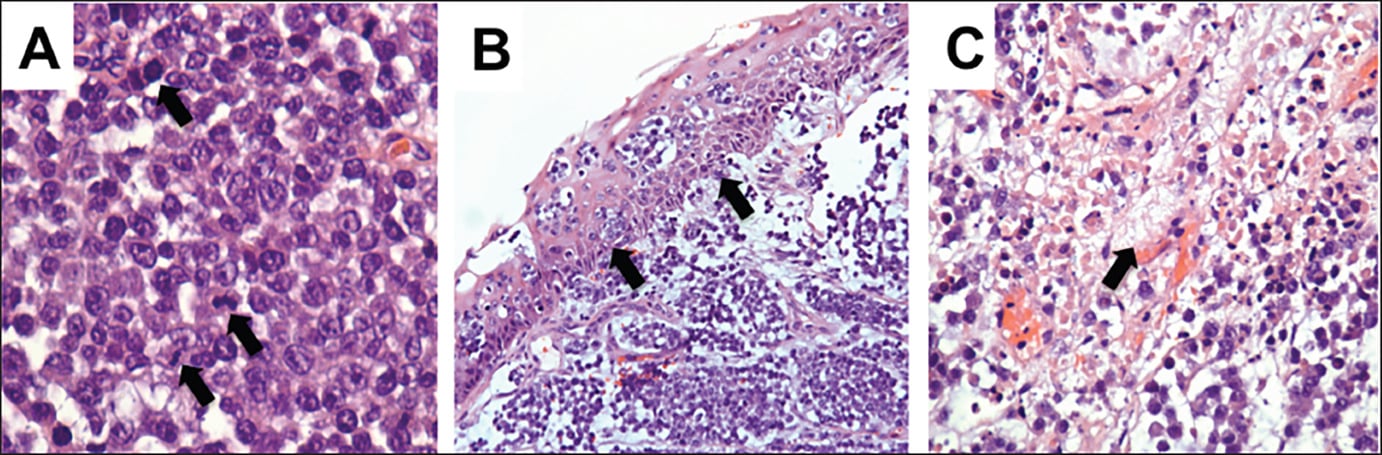
Характерните морфологични характеристики включват:
- хиперцелуларност (много клетки, като преобладават младите форми)
- ядрен и клетъчен плеоморфизъм (способност за проява в повече от една форма)
- увеличена митотична активност (митоза - вид клетъчно делене)
- некроза (локална клетъчна смърт)
- дурално/костно засягане.
 Изображение: www.endocrinepractice.org
Изображение: www.endocrinepractice.org
Хипофизните карциноми са имунопозитивни за невроендокринни маркери, включително синаптофизин и хромогранин А. По-голямата част от карциномите са имунореактивни за пролактин и АКТХ, а малка част от туморите са имунореактивни са растежен хормон, гонадотропини (т.е. лутеинизиращ хормон или фоликул-стимулиращ хормон) или TSH.
При имунохистохимично изследване карциномите in situ на хипофизата показват свръхекспресия на протеин p53.
Лечение
Лечение може да се приложи поради различни причини, а потенциалните ползи варират за всеки индивид. Методите за лечение включват:
Оперативно лечение
Операцията е най-честият вид лечение за повечето хипофизни тумори. Целта на операцията е да се премахне карцинома in situ и да се запази поне малка част от нормална жлеза. Това невинаги е възможно и в някои случаи е необходимо да бъде отстранена цялата жлеза. Процедурата се нарича ендоскопска транссфеноидална резекция;
Медикаментозно лечение
Медикаментозна терапия — някои пролактин-секретиращи тумори могат да бъдат лекувани с лекарства, които намаляват производството на пролактин. Такива медикаменти са бромокриптин и каберголин. Ако се отстрани цялата жлеза, трябва да се приемат лекарства, които да заменят хормоните, които нормално се произвеждат от хипофизата (хормон-заместваща терапия);
Лъчелечение
Лъчетерапия — използва високоенергийни лъчи за унищожаване на анормални клетки и е изключително ефективна и щадяща форма на лечение. Често се използва след оперативно отстраняване при всички типове тумори на хипофизната жлеза.
Някои малки тумори, които са отдалечени от зрителните нерви, могат да бъдат подходящи за радиохирургия.
Изображение: www.freepik.com
Мониториране
Лечението на хипофизните тумори обикновено е много успешно, въпреки че при много пациенти ще се наложи да приемат хормонални заместители, понякога до края на живота си;
Редовните прегледи при ендокринолог са препоръчителни и могат да продължат няколко години. Необходимо е извършването на кръвни тестове за следене на хормоналните нива, може да се наложи и използването на методите за образна диагностика.
КАРЦИНОМ IN SITU НА ЕПИФИЗАТА
Туморите на епифизната жлеза произлизат от клетки, разположени в и около епифизата, включващи пинеалоцити, астроцити и ганглийни клетки. Основната клетка на епифизната жлеза е епифизната паренхимна клетка — пинеалоцит.
Пинеалоцитите са специализирани неврони, които са богати на невротрансмитери — серотонин, норадреналин и мелатонин. Пинеалоцитът е заобиколен от строма (опорна структура на даден орган) от фибриларни астроцити, които взаимодействат с прилежащите кръвоносни съдове, формирайки част от кръвно-мозъчната бариера.
Анатомия
Епифизата (epiphysis) или пинеалната жлеза (glandula pinealis), наричана още шишарковидно тяло — corpus pineale, представлява малко единично образувание (тежи 120 mg), представляващо част от т.нар. надхълмие — epithalamus, отнасящо се към междинния мозък. С предния си край то се свързва с междинния мозък чрез специални образувания, които се наричат юзди — habenulae. Формата на епифизата е триъгълно — овална и е леко приплесната в горно — долна и удължена в предно — задна посока. Тя заляга в улея, който се формира от двете горни хълмчета на четирихълмието на средния мозък.
Изображение: Life Science Databases (LSDB), CC BY-SA 2.1, via Wikimedia Commons
Епифизната жлеза е богато инервирана от симпатикови нервни влакна. При стимулиране, епифизата превръща импулсите, идващи от симпатиковите влакна, в хормонален отговор, изразяващ се в производството на мелатонин, което има регулаторен ефект върху различни хормони, като лутеинизиращ хормон или фоликул- стимулиращ хормон.
Подробно описание на анатомичното устройство на епифизната жлеза ще намерите в:
» Анатомия на епифиза (epiphysis)
Епидемиология
Туморите на епифизната жлеза съставляват около 0.4-1.0% от интракраниалните тумори при възрастни и 3.0-8.0% от мозъчните тумори при деца. Повечето деца са между 10-18-годишна възраст, като средната възраст е 13 години. Възрастните пациенти обикновено са над 30-годишна възраст.
Патоморфология
Туморите, локализирани в епифизната жлеза, могат да произлизат или от герминативни клетки, или от епифизните паренхимни клетки.
Герминативноклетъчните тумори са най-често срещаните тумори в тази област, като около 65% от тях са чисти герминоми.
Герминативноклетъчните тумори включват:
- гермином
- тератом (включително незрели и злокачествени тератокарциноми)
- ембрионален карцином
- ендодермален синусов тумор
- хориокарцином
- смесени герминативноклетъчни тумори
Епифизните паренхимни тумори представляват 15-30% от всички тумори на епифизната област. Те се класифицират като:
- пинеоцитом
- пинеалнопаренхимен тумор с междинна диференциация
- пинеобластом
Паренхимните тумори произлизат от невроепителните клетки на самата жлеза.
Паренхимните епифизни тумори с междинна диференциация са рядко срещани тумори, които се срещат във всички възрасти. Тези тумори заемат междинно място между пинеоцитом и пинеобластом и при определени условия могат се преобразуват в агресивни тумори, което ги доближава до характеристиките на карцином in situ.
Хистологично, епифизните тумори с междинна диференциация произлизат от пинеалоцитите или техните предшественици и се характеризират с умерено изразено клетъчно съдържание, лека до умерена клетъчна атипия и умерена митотична активност.
Туморните клетки могат да се различават по структура и функция, но всички те имат нормална функция, която се насочва от ДНК. В различните области има различни клетки, като за епифизния регион това са епендимните клетки, които покриват вътрешната повърхност на мозъчните стомахчета. Когато тези клетки се делят, техния генетичен материал се копира.
В туморите се получава събиране на мутации, които представляват грешки при "записването" на генетичния материал, което нарушава функцията на нормалната клетка. Ако анормалните клетки продължат да нарастват, те се делят и водят до образуване на повече анормални клетки, като струпването на изменени клетки може в крайна сметка да се превърне в тумор.
Изображение: www.sciencedirect.com
Класификация
През 2007 година Световната здравна организация (СЗО) създава "Класификация на туморите на нервната система". Според тази класификация туморите, засягащи нервната система, включително и епифизната жлеза, се разделят на два стадия:
- Стадий I — туморите в този стадий се развиват сравнително бавно. Те имат слабо изразен анормален микроскопски вид и могат да се разпространят в околната нормална тъкан. Туморите от този клас могат да се появят отново като тумор с по-висока степен на диференциация;
- Стадий II — тези тумори са злокачествени. При този тип тумори клетките представляват активно делящи се анормални клетки. Туморните клетки често се разпространяват в околната мозъчна тъкан;
Клинична картина
Клиничните синдроми, свързани с епифизните тумори, са пряко свързани с нормалната епифизна анатомия, както и с туморната хистология.
Най-честият симптом е главоболие. Тъй като главоболията се срещат често, повечето хора не им обръщат внимание, което прави мозъчните тумори толкова опасни.
В някои случаи пациентите се оплакват от диплопия (двойно виждане). Възможно е понякога пациентите да страдат от гадене и повръщане.
Диагноза
Диагнозата на туморите на епифизата включва изследване на туморните маркери в серума и цереброспиналната течност, което дава ценна информация при предоперативната оценка.
Туморните маркери са най-полезни при пациенти с герминативноклетъчни тумори. Експресията на алфа-фетопротеин и човешки хорионгонадотропин (ЧХГ) е показателна за злокачествени герминативноклетъчни заболявания.
Изображение: www.freepik.com
Други биологични маркери за герминативноклетъчни тумори включват изоензими на лактат дехидрогеназа и плацентарна алкална фосфатаза (PLAP), въпреки че тези маркери са по-малко специфични. Изследванията на серума и цереброспиналната течност могат да бъдат използвани за диагностични цели и за следене на отговора към терапията.
Образните методи за диагностика на измененията в епифизната област включват високорезолюционен магнитен резонанс (MRI) с гадолиний.
Лечение
Терапията на епифизните тумори включва:
- лъчетерапия;
- химиотерапия;
- радиохирургия;
- хирургична интервенция — показанията за неврохирургична интервенция са свързани с тежестта и развитието на клиничната картина. Продромалните периоди могат да продължат от седмици до години. Преди операцията трябва да бъдат проучени всякакви ендокринни аномалии;
Последното предраково заболяване, което се включва в МКБ D09.3 Карцином in situ на щитовидна и други ендокринни жлези, е:
КАРЦИНОМ НА IN SITU НА НАДБЪБРЕЧНАТА ЖЛЕЗА
Анатомия
Надбъбречната жлеза — glandula suprarenalis, е чифтен орган, който се намира в ретроперитонеалното пространство и се разполага върху горния полюс на съответния бъбрек. Дясната надбъбречна жлеза, ако е гледана отпред, има триъгълна форма, а лявата е с полулунно очертание. Дясната жлеза тежи около 4-5 грама, лявата — около 5-7.
Надбъбречната жлеза се състои от две части, които имат различен произход: медуларна част или сърцевина — medulla, която има ектодермален произход и кортикална част или кора — cortex, имаща мезодермален произход. Сърцевината съставлява само 10% от общата маса на жлезата. Отвън жлезата е обвита с капсула.
Подробно описание за анатомичното устройство на надбъбречната жлеза ще намерите в:
» Анатомия на надбъбречна жлеза (glandula suprarenalis)
Изображение: www.freepik.com
Епидемиология
Карциномът in situ на надбъбречната жлеза е рядко злокачествено заболяване. Надбъбречните новообразувания се откриват най-често при аутопсия — приблизително 5-15 % от населението може да има надбъбречни инциденталоми — това са биохимично и клинично асимптоматични надбъбречни тумори, намерени случайно в резултат на образни изследвания (компютърен томограф (КТ) или магнитен резонанс) по друг повод. Само малък брой от надбъбречните тумори са функционални и още по-малък брой са злокачествени.
Честота на разпространение на злокачествените заболявания на надбъбречните жлези е около 0.6-1.67 случаи на един милион души годишно и се срещат по-често при мъже.
Етиология
Точната причина за развитие на карцином in situ на надбъбречните жлези е неясна.
Предполага се ролята на мутациите в тумор-супресорните гени, поради тяхната връзка с развитието на синдрома на Li-Fraumeni, който се характеризира с инактивиране на герминативни мутации от TP53 гена (жизненоважен тумор-супресорен ген — антионкоген) в хромозома 17. Този синдром се свързва с предразположението към други злокачествени заболявания, включително рак на гърдата, левкемии, остеосаркоми и саркоми на меките тъкани.
Патогенеза
Сред предполагаемите патогенни механизми, които могат да функционират съвместно, са:
- промените в междуклетъчната комуникация;
- паракринни и автокринни ефекти на различни растежни фактори;
- цитокини, изработени от туморните клетки
- смесена експресия на различни лиганд-рецептори по клетъчната мембрана на клетките, което ги кара да бъдат в състояние на постоянна хиперстимулация. Това вероятно води клетъчна клонална надбъбречна хиперплазия, автономна пролиферация, образуване на тумори и продукцията на хормони.
Някои изследвания показват, че някои от туморните клетки експресират менин-аберантния (аберация - леко отклонение от нормалния растеж и развитие, но без да е неправилно) генен продукт при пациенти с множествена ендокринна неоплазия тип I (MEN-1). В други случаи хибридният ген се свързва с глюкокортикоид-реагиращия алдостеронизъм.
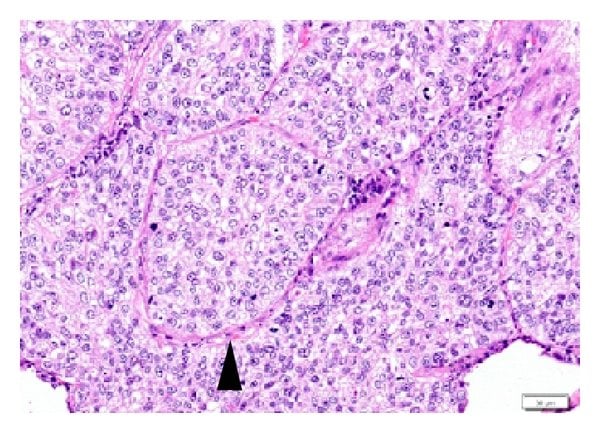 Изображение: www.researchgate.net
Изображение: www.researchgate.net
Фактът, че нормалната надбъбречна кора има множество области с адреномедуларни клетки (често образуващи големи клетъчни гнезда) и, че адренокортикалните клетки също са разпръснати в надбъбречната медула, предполага тясно взаимодействие между двете групи от клетки, въпреки техните различни филогенетични и ембрионални характеристики.
Потенциалните механизми за туморогенеза в областта на надбъбречните жлези са:
- активиране на различни протоонкогени — Ras, PKC, C myc, C fos, G протеини, G протеин — свързани рецептори;
- инактивиране на тумор-супресорни гени (антионкогени) — TP53, TP57, TP16, H19, АРС ген;
- инхибиране на клетъчното стареене и/или апоптоза (програмирана клетъчна смърт) — мутации, включващи теломераза и/или BCL-2 гени;
- промени в адренокортикалните тъканно — специфични фактори — мутации, включващи мутациите за StaR (steroidogenic acute regulatory protein), SF-1 (стероидогенен фактор) и Dax-1 транскрипционен фактор;
Клинична картина
Симптомите при карцином in situ са свързани с евентуалната промяна в нивата на хормоните, отделяни от надбъбречната жлеза.
Диагноза
Диагнозата карцином in situ се поставя с помощта на:
- лабораторни изследвания — проследяване на хормоналните нива;
- образна диагностика — компютърна томография (КТ), магнитен резонанс (MRI), ултрасонография;
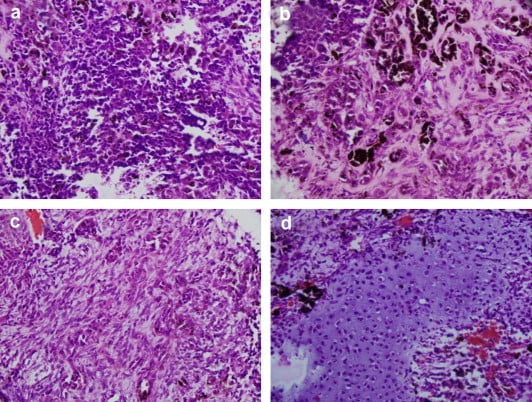
- хистологична диагноза — специфичната хистологична диагноза може да бъде трудна в случаи, че липсват клинични данни за метастази. Някои от характеристиките включват наличие на зони с калцификати или некроза, както и грубо лобулиран вид;
Характеристиките на карцином in situ включват: висока митотична активност, атипични митози (вид клетъчно делене), налобено ядро, големи области на некроза (локална клетъчна смърт), нисък процент на чисти клетки, дифузна клетъчна архитектура.
Изображение: www.researchgate.net
Лечение
Поведението при тези инциденталоми се фокусира върху:
- идентифициране на функционалните тумори и третирането им по подходящ начин (включително хирургично отстраняване);
- установяване на надбъбречните карциноми рано, с опит да се извърши пълна хирургична екстирпация (изтръгване, отстраняване);
- последващо проследяване на пациентите;
Лечението на карциномите in situ на надбъбречната жлеза включва:
- медикаментозно лечение — обхваща лечението на ендокринните синдроми, лечение и профилактика на потенциални усложнения, както и облекчаване на симптомите и намаляване на заболеваемостта;
- хирургично лечение;
Заглавно изображение: www.freepik.com
Коментари към Карцином in situ на щитовидна и други ендокринни жлези МКБ D09.3