Клинична патология на сепсис
Сепсисът е животозастрашаващо състояние, което описва системния имунологичен отговор на организма към инфекциозен процес, който може да доведе до дисфункция на органите в краен стадий и смърт.
Хипократ, през четвърти век пр.н.е., използва термина сепсис, обозначаващ разлагане. Авицена, през единадесети век, нарича болести, причиняващи гнойност, гниене на кръвта. През XIX век терминът сепсис е широко използван за описание на тежка системна токсичност. Близко производен термин на септицемия се използва за бактериална инфекция в кръвта, която е заменена с термина бактериемия. През последните два века процесите, свързани с инфекциите, бяха по-добре изучени и изяснени. Ролята на микроорганизмите в причиняването на инфекции и сложните механизми на различни вътрешни и външни токсини при увреждане на телесните тъкани, които водят до треска и шок, е открита със старателни изследвания. В началото на ХХ век терминът ендотоксин е създаден от Pfeiffer, за да обясни причинителя при заразяване с холера. По-късно е свързана с друга грамотрицателна бактериална патогенност.
Епидемиология
Сепсисът причинява милиони смъртни случаи в световен мащаб всяка година и е най-честата причина за смърт при хора, които са хоспитализирани. Броят на новите случаи на сепсис в световен мащаб се изчислява на 18 милиона случая годишно. В Съединените щати сепсисът засяга приблизително 3 на 1000 души, а тежкият сепсис допринася за над 200 000 смъртни случая годишно.
Няколко медицински състояния увеличават податливостта на човек към инфекция и развитие на сепсис. Общите рискови фактори за сепсис включват:
- възрастта (особено много младите и възрастните)
- състояния, които отслабват имунната система като рак, диабет или липса на слезка
- големи травми и изгаряния
Честотата на заболеваемостта е особено висока сред бебетата, като заболеваемостта е 500 случая на 100 000 население. Смъртността, свързана със сепсис, нараства с възрастта, от по-малко от 10% във възрастовата група от 3 до 5 години до 60% до шестото десетилетие от живота. Увеличаването на средната възраст на населението, наред с присъствието на повече хора с хронични заболявания, както и увеличаването на броя на инвазивните процедури, които се извършват, води до повишен процент на сепсис.
Честотата и броя на смъртните случаи, свързани със сепсис, се увеличават поради честата употреба на имуносупресивни лекарства. Честотата варира в зависимост от раса и пол. Най-високата честота е сред черните мъже. Честотата също показва сезонна промяна, като най-голям е случаят през зимата, вероятно поради увеличеното разпространение на респираторните инфекции през този сезон. По-възрастните пациенти (над 65 години) представляват повечето (60%-85%) случаи при клинична патология на сепсис, дължащи се на множество коморбидности и чести хоспитализации.
Етиология
Инфекциите, водещи до сепсис, обикновено са бактериални, но могат да бъдат гъбични или вирусни. Грам-положителните бактерии са основната причина преди въвеждането на антибиотици през 50-те години. След въвеждането на антибиотици грам-отрицателните бактерии се превръщат в преобладаващата причина от 60-те до 80-те години на миналия век. След 80-те години се смята, че грам-положителните бактерии, най-често стафилококи, причиняват повече от 50% от случаите. Други често замесени бактерии включват Streptococcus pyogenes, Escherichia coli, Pseudomonas aeruginosa и Klebsiella видове. Гъбичният сепсис представлява приблизително 5% от тежки случаи на сепсис и септичен шок. Най-честата причина е инфекцията от дрожди от вида Candida, честа болнична инфекция.
Най-честите места на инфекция, водещи до тежък сепсис, са белите дробове, коремът и пикочните пътища. Обикновено 50% от всички случаи започват като инфекция в белите дробове. Не се открива окончателен източник в една трета до половината от случаите.
Етиологията на сепсиса е многообразна, а клиничните указания за различни системи на органи помагат за подходяща обработка и диагностика. Също така е уместно да се прави разлика между инфекциозните и неинфекциозните причини за треска при септичен пациент. По-долу са специфичните етиологии на органна система за възможен сепсис:
- Кожа/меки тъкани - некротизиращ фасциит, целулит, мионекроза или газова гангрена.
- Инфекция на рана - възпаление, оток, еритема, изпускане на гной, с положително оцветяване по Грам и култура в резултат на разрези и дренажи или дълбоки култури.
- Горни дихателни пътища - фарингит, тонзилит или синузит, наред с други, с възпаление, ексудат със или без подуване и лимфаденопатия или положителна култури.
- Долни дихателни пътища - пневмония, емпием или белодробен абсцес, наред с други, с продуктивна кашлица, плевритна болка в гърдите, консолидация при аускултация.
- Централна нервна система - менингит, мозъчен абсцес или инфектиран хематом, наред с други, с признаци на менингеално дразнене.
- Цереброваскуларна система - миокарден инфаркт, остра клапна дисфункция, миокардит, перикардит, разрушена аневризма на аортата, аортит или септична емболия.
- Съдови катетри (артериални, венозни) - зачервяване или дренаж на мястото на поставяне.
- Стомашно-чревни - колит, инфекциозна диария, исхемична черва или апендицит, наред с други.
- Вътреабдоминални - бъбречен абсцес, пиелонефрит, панкреатит, холецистит, абсцес на черния дроб, интраабдоминални абсцеси или перфорация, компрометиране или разкъсване на интраабдоминална или тазова структура.
- Уринарният тракт - цистит, пиелонефрит, уретрит или бъбречен абсцес.
- Женски генитален тракт - тазова възпалителна болест, цервицит или салпингит.
- Мъжки генитален тракт - орхит, епидидимит, остър простатит, баланит или простатен абсцес.
- Двигателен апарат - остеомиелит, септичен артрит.
- Неспецифични системни фебрилни синдроми - бабезиоза, рикетсиални заболявания, лаймска болест, коремен тиф.
Патогенеза
Сепсисът се причинява от комбинация от фактори, свързани с конкретния нахлуващ патоген(и) и със състоянието на имунната система на гостоприемника. Ранната фаза на сепсис, характеризираща се с прекомерно възпаление (понякога в резултат на цитокинова буря), може да бъде последвана от продължителен период на намалено функциониране на имунната система. Всяка от тези фази може да се окаже фатална. От друга страна, синдромът на системен възпалителен отговор се среща при хора без наличие на инфекция, например при тези с изгаряния, политравми или първоначалното състояние при панкреатит и химичен пневмонит. Въпреки това сепсисът причинява подобен отговор на синдром на системен възпалителен отговор.
Бактериалните фактори на вирулентност, като гликокаликс и различни адхезини, позволяват колонизация, имунна евазия и установяване на заболяване при гостоприемника. Счита се, че сепсисът, причинен от грам-отрицателни бактерии, се дължи до голяма степен на отговор на гостоприемника към липидния компонент на липополизахарид, наричан още ендотоксин. Сепсисът, причинен от грам-положителни бактерии, може да бъде резултат от имунологичен отговор на липотейхоевата киселина на клетъчната стена. Бактериалните екзотоксини, които действат като суперантигени, също могат да причинят сепсис. Суперантигените свързват едновременно основен хистосъвместим комплекс и Т-клетъчни рецептори при липса на представяне на антиген. Това принудително рецепторно взаимодействие индуцира производството на противовъзпалителни химични сигнали (цитокини) от Т-клетки.
Има редица микробни фактори, които могат да причинят типичната септична възпалителна каскада. Нахлуващият патоген се разпознава по неговите патоген-свързани молекулярни модели. Примерите за последните включват липополизахариди и флагелин в грам-отрицателни бактерии, мурамил дипептид в пептидогликана на грам-положителната бактериална клетъчна стена и бактериална ДНК. Тези патоген-свързани молекулярни модели се разпознават от рецепторите за разпознаване на модели (PRRs) на вродената имунна система, които могат да бъдат свързани с мембрана или цитозол. Има четири фамилии рецептори: тол-подобни рецептори, C-тип лектинови рецептори, NOD-подобни рецептори и RIG-I-подобни рецептори. Неизменно свързването на патоген-свързани молекулярни модели и рецептори за разпознаване на модели ще предизвика серия от вътреклетъчни сигнални каскади. Вследствие на това транскрипционните фактори като ядрен фактор-капа B и активатор протеин-1 ще регулират експресията на провъзпалителни и противовъзпалителни цитокини.
При откриване на микробни антигени, имунната система гостоприемник се активира. Имунните клетки не само разпознават свързани с патогена молекулни модели, но също така свързани с увреждане молекулни модели от увредени тъкани. След това се активира неконтролиран имунен отговор, тъй като левкоцитите не се набират в конкретния сайт на инфекция, а вместо това се набират по цялото тяло. След това настъпва имуносупресивно състояние, когато провъзпалителната Т-хелперна клетка 1 се измести към TH2, медиирана от интерлевкин 10, който е известен като "синдром на компенсаторен противовъзпалителен отговор". Апоптозата (клетъчната смърт) на лимфоцитите допълнително влошава имуносупресията. Впоследствие възниква многоорганна недостатъчност, тъй като тъканите не са в състояние да използват кислорода ефективно поради инхибиране на цитохром с оксидаза.
Възпалителните реакции причиняват синдром на множествена органна дисфункция чрез различни механизми, описани по-долу. Повишената пропускливост на белодробните съдове причинява изтичане на течности в алвеоли, което води до белодробен оток и остър респираторен дистрес синдром. Нарушеното използване на кислород в черния дроб нарушава транспортирането на жлъчна сол, причинявайки жълтеница (жълтеникаво обезцветяване на кожата). При бъбреците недостатъчната оксигенация води до нараняване на тубуларните епителни клетки (на клетките, облицоващи бъбречните тубули), и по този начин причинява остро увреждане на бъбреците. Междувременно в човешкото сърце нарушеният транспорт на калций и ниското производство на аденозин трифосфат (АТФ) могат да причинят депресия на миокарда, намаляване на сърдечната контрактилност и причиняване на сърдечна недостатъчност. В стомашно-чревния тракт повишената пропускливост на лигавицата променя микрофлората, причинявайки кървене на лигавицата и паралитичен илеус. В централната нервна система директното увреждане на мозъчните клетки и нарушенията на невротрансмисиите причиняват променен психичен статус. Цитокини като тумор некротичен фактор, интерлевкин 1 и интерлевкин 6 могат да активират прокоагулационни фактори в клетките, облицоващи кръвоносните съдове, което води до увреждане на ендотела. Повредената ендотелна повърхност инхибира антикоагулантните свойства, както и повишава антифибринолизата, което може да доведе до вътресъдово съсирване, образуване на кръвни съсиреци в малките кръвоносни съдове и многоорганна недостатъчност.
Клинична картина
В допълнение към симптомите, свързани с действителната причина, сепсисът често се свързва със следното - треска, ниска телесна температура, учестено дишане, учестен пулс, объркване и оток. Ранните признаци включват тахикардия, намалено уриниране и висока кръвна захар. Признаците за установен сепсис включват объркване, метаболитна ацидоза (която може да бъде придружена от тахипнея, която води до респираторна алкалоза), ниско кръвно налягане поради намалено системно съдово съпротивление, нарушения в съсирването на кръвта, които могат да доведат до органна недостатъчност.
Спадът на кръвното налягане, наблюдаван при клинична патология на сепсис, може да причини светоглед и е част от критериите за септичен шок.
Пациентите в напреднала възраст могат да проявят перитонит и да не изпитват възстановяване на нежността на корема. Възрастните индивиди, хората с диабет и пациентите на бета-блокери може да не проявяват подходяща тахикардия при падане на кръвното налягане. По-младите пациенти развиват тежка и продължителна тахикардия без хипотония, докато настъпи остра декомпенсация.
Пациентите с хронична хипертония могат да развият критична хипоперфузия при кръвно налягане, което е по-високо, отколкото при здрави пациенти (относителна хипотония). Остър хирургичен корем при бременна пациентка може да бъде трудно да се диагностицира. Най-честата причина за сепсис при бременност е уросепсис.
Ниското кръвно налягане, наблюдавано при сепсис, е резултат от различни процеси, включително:
прекомерно производство на вещества, които разширяват кръвоносните съдове като азотен оксид
дефицит на вещества, които свиват кръвоносните съдове като вазопресин, и активиране на чувствителен към АТФ калиев канали. При тези с тежък сепсис и септичен шок тази последователност от събития води до вид циркулаторен шок, известен като дистрибутивен шок.
Патологични характеристики
По-голямата част от аутопсията и микроскопските находки при свързано със сепсис увреждане на клетките и тъканите, предизвикани от микроби или техните продукти и медиирани от широка каскада от ендогенни възпалителни медиатори, не са нито специфични, нито чувствителни за сепсис и в резултат на това липсват доказателства, когато считани за изолирани находки. Независимо от това, откриването на различни потенциално предизвикани от сепсис патологични промени чрез рутинно хистологично изследване може да се счита до известна степен характерно в рамките на цялата история на случая и следователно може да добави съответна информация към изясняването след смъртта на потенциално свързани със сепсис смъртните случаи.
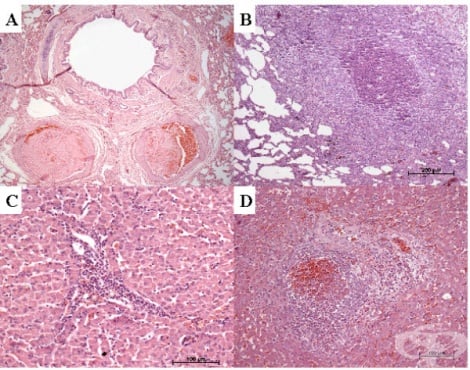
Морфологичните промени на белия дроб са следствие от патофизиологични промени, дефинирани от термина остър респираторен дистрес синдром. Макроскопски белите дробове при този синдром обикновено проявяват синкавочервен цвят. Теглото на органа се увеличава поради белодробен оток, задръствания и белодробен капан на възпалителните клетки. На срез белите дробове обикновено са мокри поради натрупване на богата на протеин оток в алвеоларните пространства и интерстициален оток. Количеството калносива течност, изтичаща от изрязаните участъци, силно зависи от количеството на венозните инфузии, приложени преди смъртта.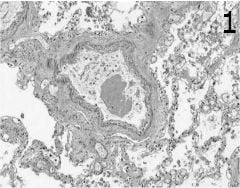
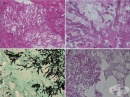
При микроскопско изследване, особено при септичен шок, често има белязана агрегация на тромбоцити с фибринови отлагания в белодробните съдове (фигура 1). Съобщава се за поява на микротромбози и мегакариоцити в белодробната микроваскулатура, че се появяват по-често при септичен шок, отколкото при шок от друг произход. Васкуларна конгестия и повече описани хеморагични огнища, разположени в алвеоларните пространства се наблюдават хистологично в повечето случаи. Интерстициалният (периваскуларен и перибронхиален) оток и интраалвеоларните фибринови отлагания, показателни за по-ранните стадии на остър респираторен дистрес синдром, са последвани от богат на протеин интраалвеоларен оток. Плазмените протеини, клетъчните отломки и фибриновите отлагания, покриващи алвеоларния епител като хиалинови мембрани, интерстициално отлагане на възпалителни клетки и интерстициална фиброза са находки, показателни за остър респираторен дистрес синдром в напреднали стадии. Съвместното съществуване на задръствания и алвеоларен колапс („конгестивна ателектаза“) е друга честа находка, наблюдавана не само при остър респираторен дистрес синдром, но и при септичен шок с бързо фатален ход. Хистологичната находка на белодробно улавяне на полиморфонуклеарни гранулоцити (наречена „левкоцитно залепване“), отразена от съдово задръстване и екстензивна левкостаза, най-често при пълно отсъствие, на каквато и да е интерстициална или интраалвеоларна възпалителна реакция, е поразително явление, наблюдавано в случаите на бърз фатален септичен шок. Тази констатация обаче може да се наблюдава и при хеморагичен шок.
Сепсисът води до депресирана функция на миокарда. Макроскопски, субепикардиални кръвоизливи, неравномерно разпределени и вариращи от малки петна към по-объркани хеморагични зони, са честа находка при сепсис поради дисеминирана интравазална коагулопатия или други нарушения в съсирването. Тези кръвоизливи могат да се засилят в случаите, когато външните мерки за реанимация на сърцето предхождат смъртта. Повечето пациенти, които преживяват началото на тежък сепсис за няколко дни, представляват шокови лезии в миокарда. Тези нехарактерни изменения на миокарда, като описани (коагулационна) некроза, стенопирни тромби и описани кръвоизливи, могат да варират по размер, от лезии, лесно откриваеми при груб преглед, до промени, видими само чрез микроскопия. Субендокардиални кръвоизливи, известни също като „Шийхански кръвоизливи“ са поразителна характеристика, наблюдавана в много случаи в съдебномедицинската аутопсия. Септичният шок особено често е свързан с тежка дисфункция на лявата камера. 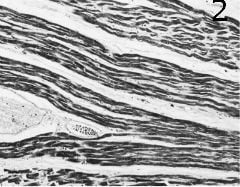 Следователно, в случаите на септичен шок, лявата камера често се разширява при аутопсия, като върхът на сърцето изглежда заоблен, а вентрикуларната стена има намален външен вид. Микроциркулаторните фибринови отлагания са друга необичайна находка в септичния миокард. Хиперконтракционните ленти и продълговатите и вълнообразни кардиомиоцити, често разделени от маркиран интерстициален оток (Фигура 2). Понякога показващи вълнообразна подредба, са друга характерна, но неспецифична находка. Фиксираната вълнообразност на миокарда бе теоретизирана по-рано, за да конфигурира на микроморфологично ниво загубата на АТФ-зависима „пластичност“ на миофиламенти поради дефектни екструзионни калциеви помпени помпи в състояние на контрактура. Хиперконтракционните ленти и удължаването на кардиомиоцитите също често се наблюдават както при внезапна, така и при продължителна смърт при липса на инфекция. Интерстициалният миокардит може да бъде открит в почти една трета от смъртните случаи, свързани със сепсис, чрез хистологични средства. Ако има в миокарда, септикопиемични абсцеси най-често се намират в субендокардиални участъци на дясната камера.
Следователно, в случаите на септичен шок, лявата камера често се разширява при аутопсия, като върхът на сърцето изглежда заоблен, а вентрикуларната стена има намален външен вид. Микроциркулаторните фибринови отлагания са друга необичайна находка в септичния миокард. Хиперконтракционните ленти и продълговатите и вълнообразни кардиомиоцити, често разделени от маркиран интерстициален оток (Фигура 2). Понякога показващи вълнообразна подредба, са друга характерна, но неспецифична находка. Фиксираната вълнообразност на миокарда бе теоретизирана по-рано, за да конфигурира на микроморфологично ниво загубата на АТФ-зависима „пластичност“ на миофиламенти поради дефектни екструзионни калциеви помпени помпи в състояние на контрактура. Хиперконтракционните ленти и удължаването на кардиомиоцитите също често се наблюдават както при внезапна, така и при продължителна смърт при липса на инфекция. Интерстициалният миокардит може да бъде открит в почти една трета от смъртните случаи, свързани със сепсис, чрез хистологични средства. Ако има в миокарда, септикопиемични абсцеси най-често се намират в субендокардиални участъци на дясната камера.
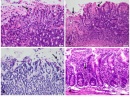
Макроскопски черният дроб в шок е увеличен, показва напрегната Глисонова капсула и заоблени ръбове. Теглото му често се увеличава поради натрупване на левкоцити и интерстициален оток. При септичен шок, усложнен от дисеминирана интравазална коагулопатия, петнистите кръвоизливи са честа характеристика на отрязаните участъци. 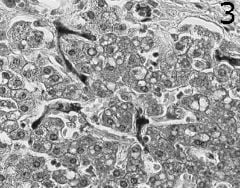 Морфологичните промени в чернодробния паренхим могат да отразяват патофизиологичните приноси по отношение на причината за шока, но патоморфологичните промени почти никога не са, достатъчно, за да се разграничат различните възможни причини за черния дроб при шок. Въпреки това, като общо правило, левкостазата на неутрофилите в чернодробните синусоиди, образуването на интрасинусоидални агрегации на фибрин (фигура 3), и вътрепаренхимните кръвоизливи са по-чести и по-изразено при септичен, отколкото хиповолемичен/травматичен шок. Некрозата на чернодробните клетки, често срещана последица от продължителен хиповолемичен шок, рядко се наблюдава при сепсис. Освен далака, черният дроб играе централна роля за разрешаването на бактериите, които навлизат в кръвта. Купферовите клетки представляват първата популация на макрофагите, която влиза в контакт с бактерии, бактериален ендотоксин и микробни остатъци от червата, транспортирани до черния дроб по порталната вена. Купферовите клетки представляват най-голямото отделение на тъканни макрофаги, представляващи 80% до 90% от всички фиксирани макрофаги. Те пребивават в лумена на чернодробните синусоиди и представляват приблизително 35% от непаренхимните чернодробни клетки. Уголемяване на пространствата на Дисе с оток на Купферовите клетки е често срещана находка в септичния черен дроб. Тази констатация обаче може да бъде прикрита от автолитични промени. При остър септичен шок, обширното натрупване на неутрофили (левкостаза) в чернодробните синусоиди се счита за характерна хистологична находка и отличителна черта на ендотоксемия от някои автори.
Морфологичните промени в чернодробния паренхим могат да отразяват патофизиологичните приноси по отношение на причината за шока, но патоморфологичните промени почти никога не са, достатъчно, за да се разграничат различните възможни причини за черния дроб при шок. Въпреки това, като общо правило, левкостазата на неутрофилите в чернодробните синусоиди, образуването на интрасинусоидални агрегации на фибрин (фигура 3), и вътрепаренхимните кръвоизливи са по-чести и по-изразено при септичен, отколкото хиповолемичен/травматичен шок. Некрозата на чернодробните клетки, често срещана последица от продължителен хиповолемичен шок, рядко се наблюдава при сепсис. Освен далака, черният дроб играе централна роля за разрешаването на бактериите, които навлизат в кръвта. Купферовите клетки представляват първата популация на макрофагите, която влиза в контакт с бактерии, бактериален ендотоксин и микробни остатъци от червата, транспортирани до черния дроб по порталната вена. Купферовите клетки представляват най-голямото отделение на тъканни макрофаги, представляващи 80% до 90% от всички фиксирани макрофаги. Те пребивават в лумена на чернодробните синусоиди и представляват приблизително 35% от непаренхимните чернодробни клетки. Уголемяване на пространствата на Дисе с оток на Купферовите клетки е често срещана находка в септичния черен дроб. Тази констатация обаче може да бъде прикрита от автолитични промени. При остър септичен шок, обширното натрупване на неутрофили (левкостаза) в чернодробните синусоиди се счита за характерна хистологична находка и отличителна черта на ендотоксемия от някои автори.
При сепсис далакът обикновено е уголемен и подут. Капсулата има напрегнат вид и лесно се разкъсва случайно по време на аутопсия. На срез повърхността показва мек и хиперемиран паренхим с червеникаво-сив, понякога кално-кафяв вид.Септикопиемични абсцеси в значителни размери са честа находка в преантибиотичната епоха, но сега са рядкост. Въпреки това, различни екзогенни или ендогенни фактори, като неподходяща или липса на специфична употреба на антибиотици, имунокомпрометират в резултат на тежко основното инвалидизиращо заболяване (злокачествено заболяване, метаболитно разстройство, имунодефицит) или съпътстващо лечение с имунопотискащи средства преди смърт, все още може да се прояви като септикопиемични абсцеси в далака.
Тежката патология на бъбреците при клинична патология на сепсис включва двустранно подуване с напрегнати капсули и силно изразена тъмночервена (претоварена) медула, която контрастира с бледността на кората. Септикопиемичните абсцеси, ако има такива, обикновено се откриват двустранно и се намират предимно в рамките на бъбречната кора. Острата тубулна некроза е най-честата форма на паренхимна остра бъбречна недостатъчност. Острата тубулна некроза, отбелязана като дилатирани тубули със сплескан базофилен и вакуолен ендотел, може да бъде предизвикана от сепсис, исхемия/реперфузия и нефротоксични лекарства и поради това често се среща при различни случаи на криминалистична аутопсия. Но по отношение на септичния шок, едно проучване съобщава, че острата тубулна некроза се наблюдава значително по-често при хора, умиращи при септични условия, отколкото при хора, умиращи от шок. В напредналите стадии на автолиза разликата между промените в бъбреците, предизвикани от явления преди или след смъртта, могат да бъдат изключително трудни и понякога невъзможни.
Субсерозните петехиални кръвоизливи, ерозии и остри язви, видими с просто око при аутопсия, са най-честите (неспецифични) шокови лезии в гастроинтеналния тракт. Септичният ентероколит се отнася до некротични и язвени промени на стомашно-чревната лигавица. Фибриновите тромби могат да се наблюдават в по-малки съдове на лигавицата на червата и субмукоза намиране на откриваемост дори върху аутопсионни образци, които са преминали през възможна автолиза. Хистологично псевдомембранозният колит се характеризира с частично или напълно разрушени колонни крипти, показващи разширяване от слуз и неутрофили. Ерозиите на лигавицата се покриват от псевдомембрани, състоящи се от фибрин, гранулоцити и слуз, придавайки на болестта типичния „вулканоподобен“ еруктивен вид (Фигура 4). Въпреки че повечето случаи на псевдомембранозен колит са резултат от терапия с клиндамицин и цефалоспорини от трето поколение, заболяването може да се прояви като усложнение на лечението с почти всеки антибиотик. Смъртоносните усложнения на псевдомембранозния колит включват шок поради изчерпване на обема, токсичен мегаколон, масивен кръвоизлив в долната част на гастроентеритната или колонална перфорация с последващ перитонит.
Библиография
https://en.wikipedia.org/wiki/Sepsis#Diagnosis
https://emedicine.medscape.com/article/234587-clinical
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6429642/
http://eknygos.lsmuni.lt/springer/143/39-85.pdf
https://www.diagnostichistopathology.co.uk/article/S0968-6053(07)00053-1/abstract
СТАТИЯТА е свързана към
- Клинична патология
- Клинична патология на инфекциозни болести
- Лечение на сепсис
- Дренаж на абсцес
- Последните дни на маршал Тито: Смъртта, която отбеляза края на една епоха
- Предимства и недостатъци на разчистването в домовете на хора, страдащи от патологично събирателство (хординг)
- Култура от кръв (хемокултура)
- Петнисти обривни елементи
- Разликата между биполярното разстройство Тип 1 и Тип 2
- д-р Станислав Василев Стоянов
- д-р Татяна Маринова Бетова
- Лечение с ампицилин

Коментари към Клинична патология на сепсис