Синдром на Cushing МКБ E24

Синдромът на Кушинг е резултат от хронично излагане на прекомерни циркулиращи нива на глюкокортикоиди. Най-честата причина за кушингоидни характеристики е употребата на ятрогенен кортикостероид, докато някои билкови препарати могат също да повишат нивата на циркулиращия кортикостероид, което води до синдром на Кушинг. Синдромът на Кушинг може да бъде взаимозаменяемо наречен хиперкортизолизъм. Aдренокортикотропно-зависимият излишък на кортизол, дължащ се на аденом на хипофизата, се нарича болест на Кушинг и е отговорен за 80% от ендогенния синдром на Кушинг.
Епидемиология
Синдромът на Кушинг, причинен от лечение с кортикостероиди, е най-честата форма. Болестта на Кушинг е рядка. Датско проучване установява, че честотата е по-малка от един случай на милион души годишно. Асимптоматичните микроаденоми (с размер под 10 милиметра) на хипофизата обаче се откриват при около всеки шести пациент.
Хората със синдром на Cushing имат повишена заболеваемост и смъртност в сравнение с общото население. Най-честата причина за смъртност при синдрома на Кушинг са сърдечно-съдови събития. Хората със синдром на Кушинг имат почти 4 пъти по-висока сърдечно-съдова смъртност в сравнение с общото население.
Етиопатогенеза
В нормалната физиология крайният продукт на оста хипоталамус-хипофиза-надбъбречна жлеза е глюкокортикоидният кортизол, секретиран от zona fasciculata на надбъбречната жлеза под стимула на адренокортикотропин (ACTH) от хипофизната жлеза. Адренокортикотропния хормон се секретира в отговор на кортикотропин освобождаващия хормон (CRH) и вазопресин от хипоталамуса. Кортизолът упражнява отрицателен контрол на обратната връзка както върху CRH, така и върху вазопресина в хипоталамуса и ACTH в хипофизата. При нормални индивиди кортизолът се секретира в циркаден ритъм. Нивата падат през деня от пик в 07.00-08.00 часа сутрин до около полунощ. След това те започват да се покачват отново в 02.00 часа през нощта.
Загубата на този циркаден ритъм, заедно със загубата на нормалния механизъм за обратна връзка на оста хипоталамо-хипофиза-надбъбречна жлеза, води до хронично излагане на прекомерни нива на циркулиращ кортизол и поражда клиничното състояние на ендогенния Cushing синдром. Всеки от многобройните синтетични стероиди, които имат глюкокортикоидна активност, ако се прилага в прекомерни количества, може да доведе до екзогенен синдром на Кушинг. Това е най-честата причина за синдрома на Кушинг, наблюдавана в общата клинична практика, обикновено поради лечение на хронични състояния като астма или ревматологично заболяване.
Етиологията на синдрома на Кушинг може най-общо да бъде разделена на две категории, ACTH-зависима и ACTH-независима.
ACTH-зависимите форми се характеризират с прекомерно производство на адренокортикотропен хормон, което стимулира и трите слоя на надбъбречната кора и води до двустранна адренокортикална хиперплазия и хипертрофия на надбъбречната жлеза. Това води до повишено тегло на надбъбречните жлези, които често показват микронодуларни или понякога макронодуларни промени. Циркулиращит глюкокортикоиди са повишени и често, в по-малка степен, са придружени от повишаване на серумните андрогени.
АСНТ-независимите форми представляват хетерогенна група, характеризираща се с ниски нива на плазмен АСТН, било поради надбъбречната хиперсекреция на глюкокортикоидите, или вторична спрямо екзогенното приложение на глюкокортикоиди. С изключение на надбъбречните аденоми, които обикновено секретират само глюкокортикоиди, сред другите ендогенни надбъбречни образувания обикновено има и повишаване на андрогените, а понякога и на стероидните предшественици. Микроскопският и макроскопичният вид на незасегнатата надбъбречна тъкан зависи главно от етиологията на разстройството.
ACTH-зависим синдром на Кушинг
Болест на Cushing
Зависимият от хипофизата синдром на Кушинг, по-известен като болест на Кушинг, е най-честата причина за ендогенния синдром на Кушинг, представляващ 60-80% от всички случаи. Епидемиологичните проучвания от Европа предполагат, че честотата е между 0,7 и 2,4 на милион годишно. Той се среща много по-често при жените, обикновено между 25 и 40 годишна възраст.
Почти винаги се дължи на аденом на кортикотрофа. Въпреки че е описана очевидна нодуларна кортикотропна хиперплазия (при липса на CRH-продуциращ тумор), тя е рядка при големи хирургични серии и съществуването й все още се обсъжда. По-голямата част от туморите са интраселарни микроаденоми (под 1 сантиметър в диаметър), въпреки че макроаденомите представляват приблизително 5-10% от туморите и може да възникне екстраселарно удължаване или инвазия. Истинските хипофизни кортикотропни карциноми с извънхипофизни метастази, причиняващи синдром на Кушинг, също са рядко описани.
Въпреки много изследвания, молекулярната патогенеза на кортикотропните аденоми остава неизвестна, но доказателствата подкрепят концепцията за първична хипофиза, а не за хипоталамусно разстройство. Въпреки това, последните данни показват, че около една трета се дължи на мутация, причиняваща конститутивно активиране на USP8, деубиквитиназа, което води до повишена експресия на EGF рецептора върху кортикотрофи. Кортикотропните аденоми рядко могат да бъдат свързани със семейни синдроми или фамилен синдром на изолиран хипофизен аденом.
Ектопичен ACTH синдром
Повечето други случаи на ендогенен ACTH-зависим синдром на Cushing, след като се изключи болестта на Cushing, са свързани с нехипофизни тумори, секретиращи адренокортикотропен хормон, наричани ектопичен ACTH синдром. Ектопичните източници на адренокортикотропен хормон произлизат от разнообразна група туморни типове, които като цяло могат да бъдат разделени на силно злокачествените карциноми и невроендокринни тумори. Най-честата причина вероятно е дребноклетъчен белодробен карцином, където се изчислява, че до 12% от случаите ще имат синдром на Кушинг. Ектопичният ACTH синдром е по-чест при мъжете и обикновено се проявява след 40-годишна възраст, но винаги трябва да се има предвид, дори при деца.
ACTH-независим синдром на Кушинг
Независимите от ACTH причини за синдрома на Кушинг, освен екзогенните глюкокортикоиди, обхващат хетерогенна група заболявания. Най-честата патология е надбъбречен аденом или карцином. Последните може да нямат някои от класическите хистологични характеристики на злокачествеността, но обикновено могат да бъдат диференцирани въз основа на тегло, ядрен плеоморфизъм, некроза, митотични фигури и съдова или лимфна инвазия. Тези характеристики са включени в оценката на Вайс за разграничение между аденоми и карциноми.
Надбъбречните аденоми се срещат най-често около 35-годишна възраст и са значително по-чести при жените, с честота около 0,6 на милион годишно. Честотата на рак на надбъбречната жлеза е приблизително 0,2 на милион годишно. Това е един и половина пъти по-често при жените и има бимодално възрастово разпределение, с пикове в детска и юношеска възраст и късно в живота.
Независимата от АСТН двустранна макронодуларна надбъбречна хиперплазия е рядка форма на синдром на Кушинг с понякога огромни възлови надбъбречни жлези. Повечето случаи са спорадични, но са докладвани няколко фамилни случая. Тъй като в тези тумори е открит адренокортикотропен хормон, по-добър термин е двустранна макронодуларна хиперплазия. В повечето случаи етиологията е неизвестна, но в няколко случая е доказано, че възлите изразяват увеличен брой рецептори, които обикновено се намират в надбъбречната жлеза, или ектопични рецептори, които след това могат да стимулират производството на кортизол.
Синдромът на Кушинг поради двустранно нодуларно надбъбречно заболяване също може да бъде характеристика на синдрома на McCune-Albright. Характерните черти са фиброзна дисплазия на костите, пигментация на кожата тип "кафе с мляко" и ендокринна дисфункция: хипофизна, щитовидна, надбъбречна или най-често гонадна хиперфункция (преждевременен пубертет). Това състояние се причинява от активираща мутация на алфа-субединицата на G протеина, стимулираща образуването на цикличен аденозин монофосфат. Това се случва в мозаечен модел в ранната ембриогенеза. Ако обаче това засяга някои надбъбречни клетки, конститутивното активиране на аденилат циклазата води до образуване на възли и излишък от глюкокортикоиди. Нормалната надбъбречна кора, където мутацията не е налице, става атрофична.
Първичното пигментирано нодуларно надбъбречно заболяване, иначе известно като микронодуларно надбъбречно заболяване, е друга рядка форма на синдрома на Кушинг. Характеризира се с малки или с нормален размер надбъбречни жлези с кортикални микронодули, които могат да имат тъмен или черен цвят. Интернодуларната кора обикновено е атрофична, за разлика от ACTH-зависимата макронодуларна хиперплазия.
Екзогенен синдром на Кушинг
Основата за ятрогенния синдром на Кушинг беше обсъдена по-рано. Развитието на характеристиките на синдрома на Кушинг зависи от дозата, продължителността и силата на кортикостероидите, използвани в клиничната практика. Днес медикаменти, съдържащи адренокортикотропен хормон се предписва рядко, но също така ще доведе до кушингоидни характеристики, ако се прилага дългосрочно. Някои характеристики, като повишаване на вътреочното налягане, катаракта, доброкачествена вътречерепна хипертония, асептична некроза на главата на бедрената кост, остеопороза и панкреатит, се съобщават като по-чести при ятрогенен, отколкото ендогенен синдром на Кушинг, докато други характеристики, особено хипертония, хирзутизъм, и олигоменорея/аменорея, са по-рядко разпространени. Не е ясно обаче дали това са истински разлики.
Псевдо-Кушинг синдром
Това са състояния, при които пациентът има клинични характеристики, предполагащи истински синдром на Кушинг, и някои биохимични доказателства за хиперкортизолемия. И двете се разрешават след излекуване на предразполагащото състояние. Патофизиологията не е ясно установена. Депресията и злоупотребата с алкохол са двете най-често срещани такива състояния.
Клинична картина
Клиничните прояви при синдрома на Кушинг са резултат от хронично излагане на излишни глюкокортикоиди и показват широк спектър от аномалии, от леко субклинично заболяване до тежки прояви.
Симптомите включват бързо наддаване на тегло, особено на торса и лицето с щадене на крайниците (централно затлъстяване). Общите признаци включват растежа на мастни възглавнички по ключицата, по задната част на врата („биволска гърбица“ или липодистрофия) и по лицето („лунно лице“). Други симптоми включват ексцесивно изпотяване, разширяване на капилярите, изтъняване на кожата (което причинява лесно натъртване и сухота, особено на ръцете) и лигавиците. Лилави или червени стрии на торса, глутеусите, крайниците или гърдите също е характерно проявление на болестта. Други симптоми могат да бъдат проксимална мускулна слабост (бедрата, раменете) и хирзутизъм, алопеция и/или изключително суха и чуплива коса. В редки случаи синдрома на Кушинг може да причини хипокалциемия. Излишъкът от кортизол може да повлияе и на други ендокринни системи и да причини, например, безсъние, намалено либидо, импотентност при мъжете и аменорея, олигоменорея и безплодие при жените поради повишаване на андрогените.
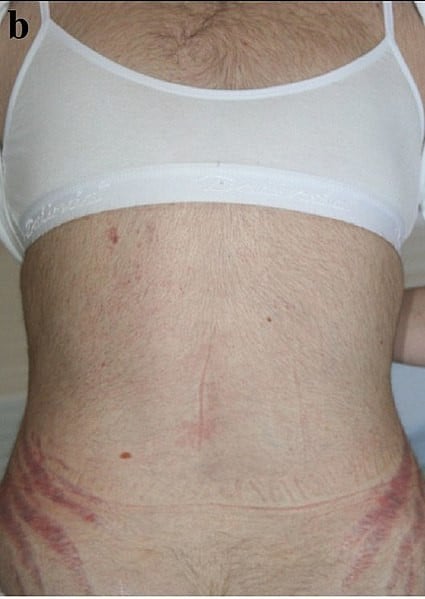
Изображение: Ozlem Celik, Mutlu Niyazoglu, Hikmet Soylu and Pinar Kadioglu, CC BY 2.5
Много от характеристиките на синдром на Cushing са тези, които се наблюдават при метаболитен синдром, включително инсулинова резистентност, хипертония, затлъстяване и повишени нива на триглицериди в кръвта.
Когнитивните състояния, включително дисфункции на паметта и вниманието, както и депресията, обикновено се свързват с повишени нива на кортизол, и могат да бъдат ранни показатели за екзогенни или ендогенни заболявания. Депресията и тревожните разстройства също са често срещани.
Други поразителни и тревожни кожни промени, които могат да се появят при синдрома на Кушинг, включват акне, податливост към повърхностни гъбични инфекции (дерматофити и маласезия) и характерните лилави, атрофични стрии по корема.
Други признаци включват повишено уриниране (и придружаващо повишена жажда), постоянно високо кръвно налягане и инсулинова резистентност (особено често при производството на АСТН извън хипофизата). Инсулиновата резистентност е придружена от кожни промени като acanthosis nigricans в аксилата и около врата. Нелекуваният синдром на Кушинг може да доведе до сърдечни заболявания и повишена смъртност. Кортизолът може също така да проявява минералокортикоидна активност във високи концентрации, влошава хипертонията и води до хипокалиемия (често срещана при ектопична секреция на АСТН) и хипернатриемия. Освен това прекомерните количества кортизол може да доведе до стомашно-чревни смущения, опортюнистични инфекции и нарушено заздравяване на рани, свързани с потискането на кортизола на имунните и възпалителни реакции. Остеопорозата също е проблем при синдрома на Кушинг, тъй като остеобластната активност е инхибирана. Освен това синдромът на Кушинг може да причини болки в ставите, особено в тазобедрената става, раменете и долната част на гърба.
Може да настъпят промени в мозъка като церебрална атрофия. Тази атрофия е свързана с области с високи концентрации на глюкокортикоидни рецептори като хипокампуса и корелира силно с психопатологичните промени в личността.
Синдромът на Кушинг поради излишък на АСТН може също да доведе до хиперпигментация. Това се дължи на производството на стимулиращ меланоцитите хормон като страничен продукт от синтеза на ACTH от про-опиомеланокортин.
Когато синдромът на Кушинг е причинен от повишаване на кортизола на нивото на надбъбречните жлези (чрез аденом или хиперплазия), отрицателната обратна връзка в крайна сметка намалява производството на адренокортикотропен хормон (АСТН) в хипофизата. В тези случаи нивата на ACTH остават ниски и не се развива хиперпигментация.
Диагноза
Както беше посочено по-горе, има много клинични характеристики в различни комбинации при синдрома на Кушинг, но малък брой патогномонични такива, и обикновено предполагат необходимостта от биохимично изследване. Основата за установяване на диагнозата на синдрома на Кушинг е биохимично потвърждение на хиперкортизолизма, преди всеки тест за диференциална диагноза по отношение на конкретна причина.
Хиперкортизолемията, заедно със загубата на нормалния циркаден ритъм на секреция на кортизол и нарушената обратна връзка на оста хипоталамо-хипофиза-надбъбречна жлеза, са основните биохимични характеристики на синдрома на Кушинг. Почти всички тестове за потвърждаване на диагнозата се основават на тези принципи. Освен това, за да се установи синдром на Кушинг, първоначално трябва да се използват тестове с висока чувствителност, за да се избегнат по-леки случаи. След това могат да се използват тестове с висока специфичност за изключване на фалшиви положителни резултати.
Тест късно вечерта за кортизол в слюнката
Измерването на кортизол в слюнката през нощта точно отразява концентрацията на свободен кортизол в плазмата, тъй като кортизол-свързващият глобулин отсъства в слюнката. Загубата на циркадния ритъм на секреция на кортизол чрез измерване на среднощния слюнчен кортизол може да се използва като чувствителен скринингов тест за синдром на Кушинг. Поради простата неинвазивна процедура за събиране, която може удобно да се извършва у дома, и факта, че слюнченият кортизол е стабилен в продължение на дни при стайна температура, той предлага редица атрактивни предимства пред вземането на кръв, особено при деца или при цикличен синдром на Кушинг. Понастоящем са широко достъпни анализи, използващи модификация на плазмения радиоимуноанализ на кортизол, ензимно-свързан имуносорбентен анализ или течна хроматография в тандемна спектрометрия.
Свободен кортизол в 24 часова урина
Измерването на свободен кортизол в урината е неинвазивен тест, който се използва най-често при скрининг на синдрома на Кушинг. При нормални условия 5-10% от плазмения кортизол е „свободен“ или несвързан и физиологично активен. Свързаният кортизол се филтрира през бъбреците, като по-голямата част се реабсорбира в тубулите, а останалата част се екскретира непроменена. Тъй като серумният кортизол се увеличава при синдрома на Cushing, свързващият капацитет на кортизол-свързващият глобулин е надвишен и се наблюдава непропорционално нарастване на свободен кортизол в урината. По този начин, 24-часовото събиране на свободен кортизол в урината произвежда интегрирана мярка на серумния кортизол, изглаждайки вариациите в кортизола през деня и нощта.
Основният недостатък на теста е възможността за неадекватно 24-часово събиране на урина и на пациента трябва да се дадат писмени инструкции. Също така многобройните колекции намаляват възможността за пренебрегване на епизодичната секреция на кортизол, понякога наблюдавана при надбъбречните аденоми.
Дексаметазон супресионен тест (DST)
Този тест работи на принципа, че при нормален индивидуален прием на екзогенен глюкокортикоид води до потискане на оста хипоталамо-хипофиза-надбъбречна жлеза, докато пациентите със синдром на Кушинг са устойчиви, поне частично, на отрицателна обратна връзка. Дексаметазон е синтетичен глюкокортикоид, който е 30 пъти по-мощен от кортизола и с голяма продължителност на действие. Той не реагира кръстосано с повечето анализи на кортизол. Оригиналният тест за ниски дози на дексаметазон, описан от Лидъл през 1960 година, измерва 17-хидрокси-кортикостероид в урината след 48 часа, като се приема дексаметазон 0,5 милиграма на всеки 6 часа. Обаче по-простото измерване на единична плазма или серумен кортизол в 09.00 часа сутрин е валидирано в различни серии и дава на теста чувствителност между 95% и 100%.
Образни изследвания
Изобразяването на хипофизата е важна част от диагнозата на ACTH-зависимия синдром на Кушинг, за да се идентифицира възможна хипофизна лезия и да се помогне на хирурга по време на изследването. Резултатите обаче трябва да се използват заедно с биохимичната оценка, тъй като приблизително 10% от нормалните пациенти могат да имат инциденталоми на хипофизата при ядрено-магнитен резонанс (ЯМР). Съвременните техники за ядрено-магнитен резонанс ще идентифицират аденом при до 80% от пациентите с болестта на Кушинг.
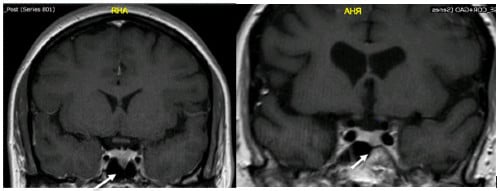
Изображение: www.ncbi.nlm.nih.gov
Компютърната томография има чувствителност само около 40-50% за идентифициране на микроаденоми и по този начин значително отстъпва на ЯМР и следователно трябва да бъде запазена за пациенти, при които ЯМР е противопоказана или липсва.
Визуализирането на ектопичен източник на ACTH може да бъде предизвикателство, но като цяло трябва да се започне с изображения на гръдния кош и корема с компютърна томография и/или ядрено-магнитен резонанс, като се имат предвид вероятните места. Най-честото място на секреторната лезия е гръдният кош и въпреки че обикновено се визуализират дребноклетъчни белодробни карциноми, малките бронхиални карциноидни тумори, които могат да бъдат с диаметър по-малък от 1 сантиметър, често се оказват по-трудни за визуализация. Ядрено-магнитния резонанс може да идентифицира лезии на гръдния кош, които не са очевидни при компютърна томография.
Лечение
Лечението трябва да бъде насочено към разрешаване на основната причина за синдрома на Кушинг, предполагайки точна диференциална диагноза. Хиперкортизолизмът, придружен с фатални последици, ако не се лекува, трябва да се контролира по всякакъв начин. Винаги, когато е възможно, хирургичната намеса, независимо от етиологията, представлява първа линия на лечение, целяща трайно излекуване и разрешаване на хиперкортизолизма заедно с неговите клинични последици. Подходът към пациента със синдром на Кушинг обаче е индивидуален, така че лъчетерапията или дори медицинската терапия като лечение от първа линия биха могли да бъдат подходящи в зависимост от етиологията, клиничното състояние и личния избор на пациента.
След лечението всички признаци и симптоми на надбъбречна недостатъчност трябва да бъдат незабавно коригирани със стероидна заместителна терапия. Асоциираните медицински разстройства на синдрома на Кушинг, като захарен диабет, остеопороза и хипертония, трябва да бъдат лекувани, за да се избегне трайна зависимост от терапията след разрешаване на основната причина за заболяването.
Също така трябва да се подчертае, че при тежки метаболитни усложнения трябва да се лекуват приоритетно, включително хипокалиемия, хипертония и хипергликемия. Всички инфекции трябва да се търсят и лекуват.
Лечение на болестта на Кушинг
Терапията от първа линия почти винаги се състои от транссфеноидална хирургия. Пациентите с персистиращ синдром на Кушинг след операцията могат да бъдат оперирани с по-нисък процент на успех от първичната хирургия и с по-висок процент на други хипофизни хормонални дефицити. Преди многократна операция е разумно да се повторят диагностични тестове, особено ако кортикотрофином не е открит при патологично изследване, за да се изключи възможността за пропуснат хипергликемичен синдром на извънматочна ACTH. Освен повторна операция, пациентите могат да бъдат лекувани или чрез лъчетерапия, медицинска терапия, или като окончателно решение на хиперкортизолизма, двустранна адреналектомия.
Лечение на ектопичен ACTH-синдром
Ако ектопичният ACTH-секретиращ тумор е доброкачествен и подлежи на хирургична ексцизия, като например при лобектомия за бронхиален карциноиден тумор, шансът за излекуване на синдрома на Кушинг е голям.
Локалната лъчетерапия след хирургична резекция на ектопичен АСТН-секретиращ източник може също да бъде от полза, особено при неметастатични гръдни карциноидни тумори.
Ходът на заболяването се определя главно от вида на тумора, наличието на метастази и степента на хиперкортизолизъм. Най-ниската степен на преживяемост идва с дребноклетъчен рак на белия дроб, медуларен рак на щитовидната жлеза и гастриноми.
Независимо от прогнозата, контролът върху хиперкортизолизма трябва да бъде установен медицински или чрез инхибиране на стероидогенезата, или чрез извършване на индуцирана от митотан медицинска адреналектомия. Ако медицинското управление се провали, хирургичната двустранна адреналектомия може да бъде опция. Пациентите, при които е установен контрол върху хиперкортизолизма, могат да развият хиперплазия на тимуса, която трябва да се разграничава от туморни метастази или първичен тимусен тумор. В случаите, когато първичният туморен произход остава неизвестен, терапията с надбъбречните инхибитори може да се поддържа, докато пациентът се подлага на периодично повторно изследване за локализация на тумора.
Лечение на ACTH-независим синдром на Кушинг
Адреналектомията е избрано лечение за всички случаи на ACTH-независим синдром на Кушинг. Това е или едностранно в случай на надбъбречен аденом или карцином, или двустранно в случай на двустранна хиперплазия, било то микронодуларна или макронодуларна. Единственото изключение може да бъде случаят с по-лек хиперкортизолизъм при макронодуларна хиперплазия, когато едностранната адреналектомия може да осигури хормонален контрол, поне временно. Предоперативно може да се използва терапия с инхибитор на надбъбречните ензими, така че клиничното състояние на пациента да се подобри, като по този начин се намали рискът от усложнения. В случаите, когато макронодуларната хиперплазия идва като следствие от аберантен хормонален рецептор, еукортизолемията може да бъде постигната чрез използване на подходяща рецепторна блокада.
При надбъбречните аденоми лечението след операция в опитни ръце се доближава до 100% и е свързано с ниска заболеваемост и смъртност.
Медицинска терапия на синдрома на Кушинг
Ролята на медицинското лечение на синдром на Cushing е важна. Рутинната практика на много групи е да се лекуват предварително пациенти със синдром на Кушинг преди хирургично лечение, за да се обърне хиперкортизолемията и нейните метаболитни последствия и да се надяваме да намалим усложненията от окончателната процедура. По същия начин е желателно медицинско лечение при пациенти с болест на Кушинг, докато се чака лъчетерапия на хипофизата да влезе в сила. При пациенти, при които операцията и/или лъчетерапията са се провалили, медицинското управление често е от съществено значение преди (или дългосрочно като алтернатива на) двустранната адреналектомия.
Най-често използваните агенти са инхибитори на надбъбречните ензими, но също се използват адренолитични агенти, насочени към хипофизата терапии или антагонисти на глюкокортикоидни рецептори. Лекарствата могат да се използват в комбинации в по-ниски дози, целящи намаляване на страничните ефекти със синергични ефекти.
Когато се определя подходът към лечението, първата стъпка е да се определи дали крайната цел е намаляване на нивото на серумния кортизол в рамките на нормалните стойности или пълна блокада на секреция на кортизол. Последният подход е удобен за пациенти с по-променлива секреция, докато пациентите с по-малка вариабилност могат да се възползват повече от понижаване на стойностите до нормалния диапазон и следователно избягване на необходимостта от стероидна заместителна терапия, както и възможност за странични ефекти, свързани с по-високата дози, необходими за тази стратегия.
Заглавно изображение: freepik.com
Видове Синдром на Cushing МКБ E24
Симптоми и признаци при Синдром на Cushing МКБ E24
ВсичкиЛечение на Синдром на Cushing МКБ E24
Изследвания и тестове при Синдром на Cushing МКБ E24
Библиография
https://www.ncbi.nlm.nih.gov/books/NBK279088/
https://www.ncbi.nlm.nih.gov/books/NBK470218/
https://emedicine.medscape.com/article/2233083-treatment
https://en.wikipedia.org/wiki/Cushing%27s_syndrome#Epidemiology
Коментари към Синдром на Cushing МКБ E24