Карцином in situ на колон МКБ D01.0
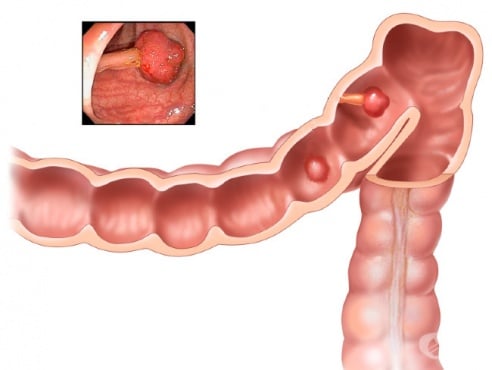
В това МКБ D01.0 Карцином in situ на колон се разглеждат предраковите изменения (карциноми in situ) в най-дългата част на дебелото черво — колон.
Карциномът на дебелото черво е едно от най-често срещаните ракови заболявания на гастроинтестиналния (стомашно-чревния) тракт в развитите страни.
Дебелото черво — intestinum crassum, е последният отдел на храносмилателния канал. То започва от илео-цекалната клапа и завършва със заднопреходното отвърстие — анус (anus). Дължината му е около 1,5-2 м. Разделя се на три части:
- сляпо черво — цекум (caecum);
- ободно черво — колон (colon);
- право черво — ректум (rectum);
Повече за анатомичното устройство на дебелото черво ще намерите при:
Анатомия на дебело черво (Intestinum crassum)
Ракът на ободното черво и този на правото черво имат много общи характеристики и често раковите изменения засягат едновременно и двете части, поради което в литературата карциномът на двете части често се разглежда като едно — колоректален карцином.
Фамилната анамнеза за рак на дебелото черво е значителен рисков фактор за развитие на болестта. Факторите, свързани с начина на хранене, също са свързани с развитието на рак на дебелото черво.
Епидемиология
Аденокарциномът на дебелото черво е втората водеща причина за летален изход от раково заболяване и засяга около 1 на 17 души.
Честота на разпространение в зависимост от пола е почти изравнена между мъже и жени, със средна възраст на възникване между 60 и 65-годишна възраст.
Последните данни показват намаляване на смъртността от рак на дебелото черво. Възможните обяснения включват:
- подобрения в диетата и начина на живот;
- извършване на скрининг и поставяне на ранна диагноза;
- предоперативно стадиране;
- използвана правилна хирургична техника;
- използването на адювантна терапия;
Рискови фактори
Начин на живот
Първоначални епидемиологични приучвания показват, че увеличеният прием на диетични фибри има проективен ефект за развитие на колоректален карцином, докато повишен прием на мазнини увеличава риска за възникването на дебелочревен карцином.
Впоследствие, големи проучвания показват, че диетичните фибри не повлияват значително риска за последващ рак на дебелото черво. Въпреки че някои плодове и зеленчуци могат да имат защитен ефект, самостоятелното приложение на диетични фибри изглежда има малко влияние върху риска от развитие на рак на дебелото черво.
Консумацията на червено месо и алкохол също увеличава опасността за развитие на колоректален карцином.
Абдоминалното затлъстяване също се свързва с повишен риск за развитие на аденоми. Пациентите с индекс на телесна маса (BMI) 25 или по-висок са със значително по-висок риск за развитие на колоректални аденоми в сравнение с тези, чийто BMI е по-малък от 25. Множество епидемиологични проучвания показват, че затлъстяването увеличава, а редовната физическа активност намалява риска за развитие на колоректален карцином.
Американското онкологично дружество (American Cancer Society) издава следните препоръки за начин на живот и хранене, насочени към общата превенция на рак:
- постигане и поддържане на оптимално тегло през целия живот;
- избягване на прекомерното наддаване на тегло при всички възрасти. За тези, които в момента са с наднормено тегло или затлъстяване, загуба на дори една малка част от теглото е от полза за здравето и добро начало на здравословен живот;
- започване на редовна физическа активност и ограничаване консумацията на висококалорични храни и напитки, като това е основната стратегия за поддържане на здравословно тегло;
- възрастните индивиди трябва да извършват минимум 150 минути умерена физическа активност или 75 минути енергична дейност всяка седмица или друга еквивалентна комбинация;
- децата и юношите трябва извършват най-малко 1 час дневно умерена или интензивна физическа дейност, с интензивна физическо натоварване най-малко 3 дни всяка седмица;
- ограничаване на заседналия начин на живот;
- здравословен хранителен режим, с наблягане върху растителните храни;
- избор на храни и напитки в количества, които спомагат за постигане и поддържане на здравословно тегло;
- ограничаване консумацията на преработено и червено месо;
- консумиране на пълнозърнести храни вместо преработени зърнени продукти;
- ограничена употреба на алкохол;
Дългогодишното тютюнопушене има отрицателен ефект при развитието на дебелочревни аденоматозни полипи и води до повишен риск от развитие на колоректален карцином. Индивидите, които са дългогодишни пушачи, са с 3 пъти по-голям риск за развитие на аденоми и приблизително 2 пъти по-голям риск за развитие на колоректален карцином. Пациентите трябва да бъдат насърчавани да откажат от пушенето.
Аденоматозни полипи
Повечето колоректални карциноми се развиват от аденоматозни полипи.
При разпределение по възраст и географско местоположение, честотата на развитие на полипите варира пропорционално на честотата на развитие на колоректален рак. Много от ранните ракови заболявания произхождат от полипи.
Повече от 33% от пациентите, които се подлагат на резекция (частично или пълно изрязване на част от орган) като метод за лечение на рак на дебелото черво, имат един или повече полипи по червото. Освен това, около 75% от пациентите със синхронен (наличие на два или повече карциноми по едно и също време) карцином на дебелото имат полипи. Наличието на полипи удвоява риска от последващи (метахронни) карциноми на дебелото черво.
Чревната лигавица претърпява последователно развитие от начално формиране на полип до развитие на чист карцином. Развитието на нормална чревна лигавица от доброкачествен аденом до инвазивен карцином се свързва с редица генетични явления, при които спорадични точкови мутации причиняват активиране на протоонкогени и загуба на тумор-супресорни гени.
Пролиферацията (увеличаване на броя) на колоноцити от стволови клетки в дебелочревните крипти обикновено се ограничава до долната една трета от криптата. При полипите тази пролиферативна активност са разпространява нагоре, като първо образуват микроаденоми, които след това прогресират до ясно видими аденоми.Тези аберантни (анормални) клетъчни линии не могат да преминат през нормално зреене и апоптоза (програмирана клетъчна смърт), което в крайна сметка води до огнищно разрастване на диспластичната лигавица в анормалните крипти. Тези прогресивни молекулярно-генетични промени и последващата нарушена регулация на клетъчния растеж и пролиферация в крайна сметка водят до развитието на инвазивен карцином.
Това е много бавен процес — времето, необходимо на един типичен аденоматозен полип да удвои размерите си, е около 10 години.
Епидемиологичните изследвания показват пряка връзка между честота на колоректален карцином и приемът на животински мазнини и месни продукти. Причината за това е, че увеличаването на наситените животински мазнини води до увеличаване на анаеробните бактерии в чревната микрофлора. Това води до прекомерно производство на неконюгирани (свободни) жлъчни киселини, които са канцерогенни (водят до развитие на рак).
Фамилна анамнеза
Фамилната анамнеза безспорно има значение за развитието на карцином in situ на дебелото черво и е налице при около 25% от пациентите с колоректален карцином ин ситу. Относителният риск се увеличава за всеки роднина от първа степен с анамнеза за колоректален карцином in situ.
Мутациите на K-ras (Kirsten rat sarcoma viral oncogene homolog) протоонкогена в соматичните (телесните) клетъчни линии, както е при последователността аденом-карцином, са от голямо значение. Генетичните аномалии в зародишните клетъчни линии са отговорни за развитието на два различни и значими синдроми, свързани с наследствения колоректален карцином:
- фамилна аденоматозна полипоза (FAP);
- наследствен неполипозен рак на дебелото черво (HNPCC);
Фамилната аденоматозна полипоза е най-редкият наследствен синдром, имащ връзка с рака на дебелото черво, като представлява около 0.5% случаите с дебелочревен карцином.
FAP синдромът се дължи на наследствена автозомно-доминантна мутация на APC (Adenomatous polyposis coli) тумор-супресорния ген в хромозома 5q21, с непълна пенетрантност (засягане), т.е. 50%.
Спонтанните мутации представляват приблизително 20% от случаите, в които преди това не е била налице фамилна анамнеза.
Фамилната аденоматозна полипоза най-често се характеризира с появата на стотици до хиляди аденоми на дебелото черво, които обикновено започват по време на юношеството (средната възраст за образуване на полип е приблизително 15 години) и е почти 100% вероятност за развитие на карцином in situ на дебелото черво, ако червото не се отстрани (средната възраст за развитието на рак е приблизително 40 години).
Съществува и атенюиран (отслабен) фенотип на FAP, при който пациентите обикновено имат по-малко от 100 аденоми с десностранно преобладаване. При пациентите с атенюиран фенотип заболяванеот обикновено се проявява по-късно през живота, като при тях съществува около 70% риск за развитие на колоректален карцином.
Освен класическата фамилна полипоза, съществуват 3 други важни синдроми, свързани с FAP:
- лицата със синдром на Гарднър (Gardner) развиват дезмоидни (доброкачествени мекотъканни) тумори, остеоми, гастродуоденални (на стомаха и дванадесетопръстника) полипи, вродена хипертрофия на пигментния епител на ретината, периампуларни (около ампулата на Фатер, Vater) тумори, както и полипози;
- синдромът на Турко (Turcot) е свързан с полипоза и злокачествени заболявания на централната нервна система, включително невроепителни тумори като медулобластом и глиобластом;
- индивидите с атенюирана аденоматозна полипоза (AAP) имат по-малко полипи, които се разпространяват по-проксимално. Пациентите с ААР са склонни да развият рак по-често в сравнение с нормалната популация, обикновено около 54-годишна възраст;
Откриването на аномалии в роднините на засегнатите лица може да доведе до поставянето на по-ранна диагноза чрез скрининг в детството посредством колоноскопия, преди развитието на чист карцином.
Наследственият неполипозен рак на дебелото черво (HNPCC), който включва синдромите Lynch I и Lynch II, съставлява 5%-10% от всички случаи на колоректален карцином in situ.
Този наследствен синдром има автозомно-доминантен тип на унаследяване и е резултат от мутация в гена за репарация (поправка) на неправилно сдвоени ДНК-бази, с почти пълна пенетрация (70% до 80%).
Лицата с Lynch I синдром развиват малко на брой проксимални полипи в ранна възраст, които често напредват бързо до множество дебелочревни карциноми.
Хората със синдром на Lynch II (наследствен неполипозен рак на дебелото черво на специфично място) развиват особеностите на Lynch I синдром плюс голям брой аденокарциноми, включващи рак на гърдата, стомаха, тънките черва, уринарния тракт, ендометриума (лигавицата на матката) и др.
Наличието на HNPCC в семейството се основава на следните критерии (Амстердамски критерии):
- колоректален карцином in situ в най-малко трима роднини, единият от които е роднина от първа степен роднина на другите двама;
- колоректален карцином in situ в най-малко две последователни поколения;
- най-малко един случай на колоректален карцином ин ситу, възникнал преди 50-годишна възраст;
При пациентите със синдрома на Линч туморите се развиват в по-млада възраст (средно 44 години), като неоплазмите (новообразуванията) се срещат по-често в проксималните части на дебелото черво и са по-склонни да развият множество карциноми. Синдромът на Lynch се среща в до 3% от всички колоректални карциноми.
Малко на брой аденоми се развиват при пациенти със синдром на Линч, като тези, при които се развива, са с по-голяма вероятност да развият колоректален рак (CRC).
Други наследствени заболявания, които могат да доведат до развитие на колоректален карцином in situ са:
- MUTYH-свързана полипоза (MAP) - това е автозомно-рецесивен синдром, причинен от биалелното (алелът е жизнеспособен ДНК код, който заема дадена позиция в хромозомата) унаследяване на мутация в MUTYH (mutY homolog)-гена, който е част от репаративния път, участващ в репарацията при оксидативни ДНК-увреждания. MAP има променлив фенотип, вариращ от CRC без полипоза до наличието на до 100 полипи;
- множество хамартоми на червата се развиват при рядко срещаните автозомно-доминантни синдроми на Peutz-Jeghers (Пойтц-Йегерс), фамилна ювенилна полипоза и синдром на Cowden (Коуден). Аденоматозните промени могат да се развият в рамките на хамартомите и да доведат до аденокарцином, най-често в колона и тънките черва;
Както беше посочено в началото на това МКБ D01.0 Карцином in situ на колон, повечето злокачествени новообразувания на колона и ректума възникват от:
Аденоматозни полипи:
Аденоматозните полипи са видими, съдържащи жлези издатини на мукозата (лигавицата). Те представляват доброкачествени тумори, произхождащи от видоизменен епител и са с променлив потенциал за развитие на злокачествено заболяване.
Лигавицата на дебелото черво представлява самообновяващ се епител, в който се наблюдава стриктно регулиран баланс между:
- клетъчната пролиферация (увеличаване на броя на клетките) в основата на чревната крипта;
- съзряване, при което дебелочревните клетки мигрират нагоре по криптата;
- избутване на стареещи и/или апоптозни (апоптоза — програмирана клетъчна смърт) клетки от горната част на криптата към лумена;
Целият този процес отнема около 3-6 дни.
Патогенеза
Аденоматозните клетки се характеризират със загуба на нормалния контрол на растежа. Тези клетки продължават да пролиферират след достигане на горната част на криптата и не се екструдират (изтеглят) в лумена. Вместо това те се размножават и се връщат обратно назад в заобикалящата нормална лигавица, предизвиквайки отговор в мезенхимната тъкан, помагаща за оформянето на микроскопската архитектура на аденома.
Скоростта на растеж и прогресиране на аденомите до карциноми е различна, но обикновено е в рамките на 10-15 години. Пациенти с наследствени форми на заболяването, например синдром на Lynch, известен и като наследствен неполипозен колоректален карцином (HNPCC), развиват значително по-бързо карцином от аденом.
Конвенционалната последователност аденом-карцином се смята генетично определен процес, който се характеризира с появата на последователни цикли от соматични мутации и клонална експанзия (разрастване) от клетки, при които се наблюдава по-дълъг период на преживяване. Първата промяна при този процес често включва инактивиращи мутации в АРС (adenomatous polyposis coli) тумор-супресорния ген (наследствени мутации в АРС гена поради фамилната аденоматозна полипоза - FAP) и соматични мутации в АРС гена, появяващи се в около 80% от спорадичните (непостоянни, появяващи се от време на време) аденоми.
Допълнителни прогресивни мутации се срещат в клетки на аденома, включително активиране на мутации в онкогените (Ki-ras) и инактивиращи мутации на допълнителни тумор-супресорни гени (напр. TP53). Някои от тези индивидуални мутации водят до образуване на клонове от клетки, които са придобили по-голяма преживяемост в сравнение с околните клетки, което води до клон от мутирали клетки. Последващите етапи на мутация и клонална експанзия в крайна сметка водят до:
- аденомен растеж;
- увеличаване на тежестта на дисплазията (промяна в клетъчния или тъканния фенотип) и, в крайна сметка, до
- придобиване на метастазните характеристики на аденокарцином;
Колоректалните карциноми ин ситу могат да се развият от или в рамките на обикновени аденоми, като процесът се провокира от герминативна (наследствена) мутация в един от гените за репарация (поправка) на неправилно сдвоени ДНК-бази (например MSH2, MLH1, MSH6, PMS2). Когато фокални (огнищни) соматични мутации или останали алели "див тип" се появят в дебелото черво, това води до:
- нарушена репарация на неправилно сдвоени бази;
- повишена честота на мутациите;
- микросателитна (къси ДНК сегменти с повтарящи се последователности) нестабилност;
- бързо прогресиране до колоректален карцином;
Последователността аденом-карцином е добре известна и се приема, че повече от 95% от колоректалните карциноми възникват от аденоми.
Честота
Честота на разпространение на аденоматозните полипи е 40-50% между 50 и 60-годишна възраст. Разпространението на аденомите на дебелото черво се увеличава с възрастта и варира в зависимост от фамилния риск за развитие на колоректален карцином в дадена популация.
С изключение на редки аденоми, които причиняват клинично значим кръвоизлив или обструкция (запушване), заболеваемостта и смъртността са основно свързани с карциноми, които могат да възникнат от аденоми.
Расата не изглежда да бъде самостоятелен рисков фактор за развитие на аденоматозни полипи.
Разпространението на аденомите се увеличава прогресивно с възрастта. Аденомите се срещат по-рядко при хора до 30-годишна възраст, освен ако не са свързани със значителна фамилна анамнеза или фамилен синдром. Повечето изследвания показват, че честотата на спорадичните аденоми започва да увеличава значително при хората на възраст между 40 и 50 години и продължава да се увеличава до 80-годишна възраст.
Счита се, че до 5% от всички колоректални карциноми възникват от добре охарактеризирани наследствени мутации. Аденоматозните полипи се срещат в по-млада възраст и са с по-висока честота при пациенти, които носят тази генетична предразположеност.
Рискови фактори
Свързаните рискови фактори включват:
- възраст;
- брой на полипите (5 или повече);
- размер (по-големи от 1 см);
- вилозна архитектура;
- проксимално разположение;
- мъжки пол;
Пушенето, индексът на телесна маса (BMI), фамилната анамнеза за колоректален карцином, както и степента на дисплазия не са свързани с по-високи рискове за развитие на аденом или карцином.
Класификация
Световната здравна организация (СЗО) класифицира аденомите в зависимост от:
- начина им на прикрепване — полипи с дръжка (краче) и такива, които са плоски (без краче);
- хистологичен вид:
- тубуларни;
- вилозни;
- смесен тип — тубуловилозни;
Аденомите са класифицирани въз основа на техния размер, структура и степен на дисплазия.
Големият размер, вилозното съдържание и високостепенната дисплазия при колоректалните аденоми са свързани с по-голяма вероятност за откриване на огнище на колоректален карцином в рамките на аденома.
Терминът "напреднал аденом" се използва за аденоми, които имат диаметър 1 см или по-голям или които имат тубуловилозни или вилозни хистологични характеристики, или високостепенна дисплазия.
Повечето аденоми са малки (< 1 см). Големите аденоми (> 1 см) са склонни към по-тежка дисплазия, по-особена архитектура, както и повишен риск от злокачествена трансформация.
Аденомите се класифицират като тубуларни, тубуловилозни или вилозни, главно въз основа на общия процент вилозно съдържание. Рискът от злокачествени заболявания се увеличава с повишаване на вилозния състав на полипа.
Около 70-85% от всички аденоми са тубуларни и обикновено са по-малки от вилозните аденоми.
Тубуловилозните аденоми съдържат около 25-75% вилозна тъкан. Тези аденоми съставляват 10-25% от всички аденоми и са склонни да бъдат с междинен размер.
Вилозните аденоми съдържат повече от 75% вилозна тъкан. Тези аденоми представляват 5% от всички аденоми — те обикновено са по-големи и имат най-голям злокачествен потенциал.
Дисплазията представлява неопластична промяна в хистологията. Всички аденоми са диспластични, показват степен на хиперхромазия (интензивно ядрено оцветяване), добре изразени ядра, ядрен плеоморфизъм (променливост в размера, формата и оцветяването на ядрата) и засилени митози. Дисплазията се класифицира като нискостепенна или високостепенна, като последната се свързва с повишен риск от злокачествено заболяване.
Хистологичните критерии, използвани за разграничаване на ниско- от високостепенната дисплазия, са:
- нискостепенна дисплазия — базални (разположени в основата на клетката) или стратифицирани (разслоени) ядра, струпвания на жлези, по-малко чашковидни клетки и муцин;
- високостепенна дисплазия — загуба на жлезистата архитектура, висока митотична (митоза — вид клетъчно делене) активност;
Разпространение
Вероятността за високостепенна дисплазия и карциномна трансформация се увеличава с размера на полипа, особено когато те са по-големи от 1 см, имат вилозен характер, налице са много полипи и възрастта на пациента при диагностициране е над 60 години.
Неоплазията се счита за напреднала, когато полипите са 1 см или по-големи в диаметър, имат вилозен компонент или висока степен на дисплазия. Повече от 25 % от напредналите полипи и колоректални карциноми са разположени в областта около flexura lienalis (флексура лиеналис - извивка на ободното черво, която е разположена в лявата подребрена област, между напречната и низходяща част на ободното черво и в близост до слезката (lien), откъдето носи името си).
Смесените полипи също имат способността да станат злокачествени, както е при синдрома на хиперпластичната полипоза.
Честота на канцерогенни полипи в поредица от ендоскопски премахнати полипи е между 0.2% и 11%.
В днешно време, броят на случаите, при които се премахват злокачествени полипи, се увеличават, причина за това са скрининговите програми.
В асимптоматична популация от хора над 50-годишна възраст, които са били подложени на директна колоноскопия, честота на аденокарциномите е била около 0.8%, като 50% от тях са били карциноми in situ или стадий I.
По време на скрининговите програми са били открити аденокарциноми в 3%-4.5% от пациентите, които се подлагат на колоноскопия след положителен фекален тест за окултни кръвоизливи.
Патоморфология
Карцином in situ, интрамукозен карцином, високостепенна дисплазия или интраепителна неоплазия представлява стадият, при който няма засягане на muscularis mucosae (мускуларис мукозе е един от подслоевете на лигавицата на червото).
Инвазивният карцином се отличава от високостепенната дисплазия именно посредством инвазията на неопластична тъкан отвъд muscularis mucosae. През този стадий не се наблюдават метастази и се класифицира като pTis или стадии 0 по системата TNM.
Термините, споменати по-горе, се означават като неинвазивна високостепенна неоплазия (NHGN) по Виенската класификация.
Карцином in situ, високостепенна дисплазия или интраепителна неоплазия съответства на карцином, който е ограничен до епителния слой, без да има инвазия в ламина проприя (lamina propria).
Интрамукозният карцином представлява карцином, характеризиращ се с навлизане в ламина проприя.
Когато карциномът се разпространи до субмукозата (подлигавицата), полипът се приема за злокачествен, в състояние да метастазира в лимфните възли или в отдалечени места. Туморите, които засягат субмукозата, се класифицират като Т1 и съответстват на стадий I от TNM-класификацията. Тези новообразувания се означават като субмукозни карциноми според Виенската класификация или като злокачествен полип.
Терминът "псевдоинвазия" се отнася до присъствието на жлезист епител под muscularis mucosae в дебелочревните полипи. Тези лезии нямат злокачествен потенциал и трябва да бъдат лекувани по подобен на аденомите начин, но в някои случаи могат да бъдат объркани с инвазивен карцином от неопитен патолог. Псевдоинвазията обикновено възниква в по-големи полипи (> 1 см), особено при тези, които са с дълги крачета и най-често се среща при полипи в сигмовидното ободно черво.
Области от аденоматозен епител се разпространяват през muscularis mucosae и се откриват в рамките на субмукозата на полипното краче.
Разселващата се жлезиста тъкан обикновено има кръгла форма, с добре изразени граници, не инфилтрира съседните структури, носи със себе си малка част от lamina propria и е цитологично (клетъчно) идентична с надлежащия аденоматозен компонент.
Кръвоизлив и отлагане на хемосидерин са често срещани и имат ключово значение при диагнозата. В допълнение могат да бъдат открити възпаление и гранулационна (незряла съединителна) тъкан.
При псевдоинвазия често се наблюдава и кистозна дилатация (разширение) на преминалите през ламина проприя жлези, като причина за това е произведеният муцин, който не може да достигне лумена на жлезите. Понякога възниква и руптура (разкъсване) на дилатираните жлези, с екстравазация (излив извън съда) на безклетъчен муцин и последваща възпалителна реакция.
Разграничаването от муцинозен (колоиден) карцином е важно и може да бъде много трудно — при муцинозния карцином муцинът съдържа злокачествени клетки, а тази характеристика не се наблюдава при псевдоинвазия.
Всички аденоми имат някаква степен на дисплазия — високо- или нискостепенна. Като цяло, високостепенната дисплазия води до по-съществени промени и включва карцином in situ на колон. Тези промени включват:
- структурна промяна, често наподобяваща жлезистата архитектура на аденомите;
- цитологични аномалии;
- клетъчен и ядрен плеоморфизъм;
- ядрен хиперхроматизъм (по-силно оцветяване на ядрото);
- загуба на ядрена полярност;
- подчертана ядрена стратификация;
Според някои автори обаче характеристиките на високостепенната дисплазия включват:
- загуба на нормалната жлезиста архитектура;
- хиперхромни клетки с многопластови неправилни ядра и загуба на муцин;
- увеличено съотношение ядро:цитоплазма;
- подчертан ядрен атипизъм с ясно изразени ядра;
- фокусен крибриформен вид;
Не е задължително присъствието на всяка от тези характеристики в еднаква степен за всеки диспластичен епител, докато нискостепенната дисплазия се проявява със същите тези промени, но по-слабо изразени.
Много фактори са свързани с по-високата вероятност за остатъчно заболяване или рецидивиращ карцином. Морфологичното описание включва полиповидни (на краче) и неполиповидни (плоски или разязвени) подтипове, съгласно Парижката класификация. При ендоскопското изследване вниманието трябва да се насочи към някои характеристики, които насочват за вероятно злокачествено заболяване. Тези характеристики включват:
- размер;
- наличието на плоска язва;
- неправилни контури;
- късо и неподвижно краче;
- невъзможност за повдигане на полипа при формирането на субмукозна издатина;
Неполиповидните колоректални неоплазми имат по-голяма асоциация с карцином (неинвазивна високостепенна неоплазия или субмукозен инвазивен карцином) в сравнение с полиповидните неоплазми, независимо от техния размер.
Стадиране
При диференцирането на аденоматозните полипи се обособяват четири степени:
- степен 1 съответства на добре диференциран чревен тип аденокарцином и се състои от добре оформени жлези с отворен лумен или с повече от 95% жлезна диференциация;
- степен 2 е умерено диференциран чревен тип аденокарцином, съдържащ солидни гнезда, с наличието само на огнищни жлези или са с 50%-95% жлезна диференциация;
- при степен 3 е налице слабо диференциран интестинален (чревен) тип карцином, карцином с клетки тип "пръстен с печат" (пръстен с камък) или муцинозен аденокарцином, състоящ се от хиперхромни (по-интензивно оцветени) клетки, подредени в солидни гнезда. Тези тумори притежават между 5% и 50% жлезна диференциация;
- недиференцирани тумори, които имат по-малко 5% жлезна диференциация, съответстват на степен 4;
Медуларни карциноми с висока микросателитна нестабилност се класифицират като недиференцирани карциноми.
Прогнозата при различните видове полипи зависи от хистологичната оценка.
Трета степен на диференциация се наблюдава при 5.7% до 9.2% от пациентите с полипи, а рискът от остатъчни лезии или рецидиви при тези случаи е от порядъка на 36%-38%. При повечето случаи степен 3 на диференциация е свързана с наличието на инвазивни аденокарциномни клетки < 1 мм от ясно отграничен ръб.
Съществуват няколко нива на инвазия на аденокарциномите в полипа:
- ниво 1 описва инвазивен аденокарцином, ограничен до главата на полипа;
- ниво 2 включва засягането на шийката на полипа;
- ниво 3 съответства на аденокарциномни клетки в крачето на полипа;
- ниво 4 на инвазия — аденокарциномните клетки инфилтрират субмукозата на нивото съседната чревна стена;
Точната хистологична оценка при това стадиране може да бъде трудно, особено диференциацията между ниво 1 и 2 и между 2 и 3.
При това стадиране, инвазивен аденокарцином в полип без краче по дефиниция отговаря на ниво 4 на инвазия.
Някои автори предлагат допълнителна система за хистологична класификация въз основа на степента на клетъчна диференциация в границите на лезията, както и в зависимост от размера и дълбочината на инвазия (навлизане) в субмукозата (подлигавицата). Съответно, степента на субмукозната инвазия (SM) се класифицира в три типа, базирани на дълбочината на инвазия:
- когато по-малко от една трета от субмукозата е инвазирана, стадият се означава като sm1. При този стадий дълбочината на инвазия е по-малка от 1 мм или 1000 µm от muscularis mucosae;
- стадий sm2 е междинен, с карциномна инвазия в средната третина на субмукозата;
- когато са ангажирани повече от две трети, стадият е sm3;
Доказано е, че проникването на ракови клетки в долната трета на субмукозата (sm3) при неподвижните лезии е свързано с по-голям риск от лимфна метастаза, в сравнение с леко изразената инвазия.
Изследванията на големи групи пациенти показват 1%-3% риск за метастази в лимфните възли в стадий sm1, 8% при стадий sm2 и около 23% при sm3.
Съществуват два основни проблема при определянето на дълбочината на субмукозната инвазия (SM):
- как да се определи дълбочината на инвазия при лезии, при които не може да се идентифицира muscularis mucosae;
- как да се определи дълбочината на SM при тумори, показващи морфологични разлики;
За решаване на първия проблем, при който muscularis mucosae не може да бъде идентифицирана поради карциномна инвазия, се определя повърхностната част на субмукозния инвазивен колоректален карцином и се измерва дълбочината на субмукозната инвазия от това изходно ниво до най-дълбокото ниво на инвазия.
За полипите на краче се използва ниво 2 на инвазия като изходно ниво (шийката на аденома, т.е. връзката между аденома и крачето).
При тези случаи честота на метастазите в лимфните възли е 0%, когато инвазията в крачето е < 3 мм или 3000 µm. При неподвижните полипи muscularis mucosae се използва като изходно ниво (линия) и вертикалното разстояние от тази линия до най-дълбоката част на инвазия представлява дълбочината на субмукозна инвазия.
Наличието или отсъствието на лимфна инвазия се определя в зависимост от това дали има туморни клетки в лимфен съд, "облицован" с ендотел, в отсъствието на червени кръвни клетки (еритроцити). Рискът за лимфно разпространение от злокачествен полип се определя при хистологичното изследване на резецирани (хирургично премахнати) проби.
Тъй като лимфните структури не преминават много извън muscularis mucosae, фокален карцином, който не е инвазирал през този слой, представлява малък или никакъв риск за метастаза в лимфен възел.
Както в субмукозата, така и в muscularis mucosae обикновено се открива плексус (сплетение) от лимфни съдове, с редки разширения в ламина проприя и ограничен до региона в основата на криптите.
Смята се, че липсата на лимфни съдове в лигавицата е причина за наблюдаваната липса на злокачествен потенциал (метастази в лимфен възел), наблюдавана при полипи, в които се открива само интрамукозен (разположен в лигавицата) карцином.
При ранните инвазивни карциноми лимфните съдове претърпяват пролиферация (увеличаване на броя) и присъстват в крачето и лигавицата на аденомите.
При злокачествените полипи лимфните съдове чест са разположени в близост до местата на инфилтративните тумори.
Няма утвърдени насоки за установяване наличието на лимфна инвазия, като истинска лимфна инвазия се среща рядко.
Лимфна инвазия се среща при малко на брой полипи, като повечето от тях имат положителни резекционни ръбове, ниво 3 инвазивен карцином или и двете.
Приблизително 12% до 16% от всички полипи показват лимфна инвазия, като при тези случаи рискът от рецидив или остатъчни лезии варира между 17% и 39%.
Наличието или отсъствието на венозна инвазия се определя от това дали има карцином в "тапициран" с ендотел (слой от епителни клетки) кръвоносен съд, заобиколен от гладкомускулна стена, но дори с тази находка разпознаването на венозна инвазия е трудно.
Съдови маркери, като например CD31, CD34 и фактор VIII, могат да помогнат при оценката на съдовата инвазия. Тези маркери силно оцветяват ендотела на кръвоносния съд, а в по-малка степен и лимфния ендотел. Разпространението на венозната инвазия в злокачествени полипи варира от 3.5% до 39%. Често венозната инвазия е свързана с лимфна инвазия и/или тумори, които имат резекционна граница на по-малко от 2 мм и/или са слабо диференцирани.
Като благоприятни хистологично се определят степен 1 или 2 диференцирани карциноми, при които карциномните клетки са най-малко на 2 мм от ясно визуализирани ръбове, резекцията се извършва en bloc и липсва съдова или лимфна инвазия.
Като неблагоприятни хистологично се определят случаи, при които:
- разстоянието между инвазивния тумор и резекционния ръб е < 2 мм или 2000 µm;
- налице е премахване на малко количество тъкан;
- има тумор с положителни резекционни ръбове;
- налице е слабо диференциран тумор (степен 3);
- налице е лимфна или съдова инвазия;
При тези случаи хирургичната резекция (изрязване) е показана поради повишения риск от метастази в лимфен възел или остатъчно заболяване.
От друга страна, в отсъствието на неблагоприятни хистологични характеристики, полипектомията (отстраняване на полипи) се счита за подходящо лечение.
Тъканните проби, които не се поддават на адекватен анализ по някаква причина, понякога насочват към конкретно решение — резекция.
Симптоми
Най-честите симптоми и признаци, които обикновено се срещат при големите аденоми, включват:
- ректално кървене — явно и окултно;
- нарушение в чревната перисталтика;
- коремна болка;
- ректален пролапс;
- периодична чревна обструкция (запушване) от голям аденом;
- инвагинация;
- голям вилозен аденом, причиняващ обилна водниста диария (среща се рядко);
Повечето пациенти нямат симптоми и аденомите се откриват по време на рутинен скрининг за рак на дебелото черво.
Диагноза
При физикален преглед обикновено се откриват доброкачествени лезии. При дигитално ректално изследване (ректално туширане) понякога могат да бъдат открити голям ректален полип или плосък аденом.
Диагностиката при такива съмнителни лезии, както и при плоските лезии, може да се извърши като се използва хромоендоскопия (техника, при която се прилага оцветяване по време на ендоскопия, за да се подчертаят различията и злокачествените промени на лигавицата, които не могат да се видят при конвенционална ендоскопия) и увеличителни техники, които могат да покажат аномалии в жлезната цитоархитектура, като същевременно дават и информация относно степента на субмукозната инвазия.
Ендоскопската ехография, използвайки високочестотна трансендоскопска мини-сонда, в момента изглежда, че е най-точният метод за диагностициране на евентуална субмукозна или по-дълбока инвазия в чревната стена, което позволява директно насочване за хирургична намеса в тези случаи, при които има по-дълбоко проникване и при които има най-голям риск от лимфна метастаза.
Други методи:
- лабораторни изследвания — пълната кръвна картина (ПКК) може да бъде полезна, тъй като при пациенти с аденом от време на време могат да се наблюдава микроцитна (недостиг на желязо) анемия поради хронична окултна загуба на кръв. Може да са необходими изследвания на желязото, защото ниски нива на серумното желязо и феритин и повишен желязосвързващ капацитет (ЖСК) понякога може да се наблюдават като резултат от загуба на кръв при някои пациенти с аденоми и карциноми на дебелото черво;
Извършват се също и:
- гваякол-базирано фекално изследване за окултни кръвоизливи (FOBT) - една малка част от големите аденоми могат да кървят периодично. В зависимост от възрастта на изследваните пациенти, 10-40% от асимптоматичните пациенти с положителен резултат за фекална окултна кръв са с напреднал аденом. FOBT скрининговите програми са предназначени за ранно откриване на рак на дебелото черво (CRC) и демонстрират ниски нива на смъртност;
- фекален имунохимичен тест (FIT) — имунохимичното изследване за човешки глобин има по-висока чувствителност за CRC и аденоми, в сравнение с FOBT и все по-често се извършва вместо гваякол-базираните тестове. FIT увеличава нивото на разкриваемост на напреднали аденоми и колоректален карцином, без да се създава голям брой от фалшиво положителни резултати, което би довело до ненужни колоноскопии;
- количествено изследване на изпражненията за кръв — за момента няма съществена роля за скрининг или диагноза на дебелочревни аденоми;
- изследване на изпражненията за генетични изменения — анализът на фекална ДНК представлява нов начин за ранно откриване, като изследванията съобщават за 62-91% чувствителност за колоректален карцином и 26-73% чувствителност за аденоми, със специфичност, варираща между 93-100%. Основният недостатък на фекалните ДНК-тестове е високата цена и ограничената наличност;
- изследване за фекален калпротектин и туморен протеин M2-PK в изпражненията — този тест също е с по-добри работни показатели, отколкото гваякол-базираните тестове, но тези по-нови изследвания също имат ниска чувствителност и по-лоша специфичност;
- други тестове — биомаркери в кръвта или урината за откриване на колоректален карцином и напреднала неоплазия, като например измерване на нивата на септин 9 в кръвта, уринни метаболити и др.
През последните години са били използвани различни серумни маркери в опит да се установи кои пациенти могат се нуждаят от хирургично лечение и кои от по-стриктно проследяване. Тези маркери включват:
- металопротеиназа 7;
- съдови адхезионни протеини;
- съдови ендотелни растежни фактори;
- цитокератини;
По-голямата част от маркерите са проучвани при пациенти, които са били оперирани от рак на дебелото черво, с инфилтрация на muscularis propria (мускулният слой на дебелото черво), така че тези резултати не могат да бъдат приложени общо за злокачествени колоректални полипи.
Изключение от тези насоки са пациенти със злокачествени полипи, които са на краче или с плоска морфология и са локализирани в ректума.
Адекватната предоперативна оценка на общото здравословно състояние на пациента е от съществено значение, преди да се реши какво лечение ще се предприеме за всеки отделен пациент. Около 50% от рецидивите след локална резекция са лечими, ако пациентите се проследяват интензивно.
Използваните методи за образна диагностика включват:
- рентгеново изследване на дебелото черво с бариева клизма (ВЕ) — позволява откриването на полипи и рак на дебелото черво (CRC). ВЕ обикновено се разглежда като по-малко чувствителна от колоноскопията при откриване на аденом, който е по-малък от 1 см, поради което обикновено се разглежда като алтернатива на колоноскопията при цялостна оценка дебело черво;
- КТ-колонография (виртуална колоноскопия) — това се очертава като перспективен метод за откриване на аденоми и карциноми на дебелото черво. До този момент КТ-колонографията има по-ниска чувствителност от оптичната колоноскопия за малки (< 1 см) аденоми, но технологията бързо се подобрява. Предимствата на виртуалната колоноскопия включват липсата на необходимост от седиране, кратко време за провеждане на теста и неинвазивност. Ако тестът е положителен, налага се извършването на стандартна колоноскопия;
- други процедури:
- гъвкава сигмоидоскопия (FS) — може да бъде използвана за визуализиране на лявата част на дебелото черво, където се намират повече от половината от всички аденоми и карциноми на дебелото черво. Ако се открие аденом, след това трябва да се извърши колоноскопия. Ако не са открити никакви аденоми, не се изисква повторна проверка в продължение на 5 години. Основните предимства на този тест са, че е по-широко достъпен и по-евтин от колоноскопията, крие по-малък риск от колоноскопията, изисква по-малка подготовка на червата. Недостатъците са, че не се визуализира цялото дебело черво, може да бъде по-некомфортно за пациентите, тъй като те не са упоени, методът е двуетапен (изисква последваща колоноскопия), ако се установят аденоми;
- колоноскопия — колоноскопията е препоръчителният скринингов метод за:
- високорискови индивиди, като например тези, които са с първа степен роднини с рак на дебелото черво/напреднал аденом;
- тези с наследствена предиспозиция (предразположение) за колоректален карцином;
- проследяване на хората, които имат персонална анамнеза за аденом или колоректален карцином;
Колоноскопията има предимството, че може едновременно да визуализира цялото дебело черво и да премахне аденом в една манипулация. Колоноскопията може да се извърши на по-дълги интервали, ако не са открити аденоми и освен това има минимален дискомфорт за пациента, тъй като той е упоен по време на изследването.
Добрата подготовка на червата е от съществено значение за адекватната визуализация на лигавицата на дебелото черво.
Ендоскопски, полипите могат да бъдат класифицирани като:
- педункулирани (мукозно краче, вмъкнато между полипа и стената на дебелото черво);
- полипи на широка основа (цялата им основа е прикрепена към стената дебелото черво);
- плоски (височината на полипа е по-малка от половината от диаметъра на полипа);
- вдлъбнати (полипи с хлътване в лигавицата на дебелочревната стена);
Недостатъците на колоноскопията са, че това е инвазивно изследване с по-висок риск от усложнения в сравнение с другите скринингови варианти, изисква седация, на пациентите им отнема повече време и затова трябва да отсъстват от работа, а освен това ще им е необходим транспорт от и до мястото, където ще се проведе изследването. Тестът изисква и пълна подготовка на червата и е скъп.
Усложненията, свързани с колоноскопията включват:
- перфорация (пробив на червото);
- кървене;
- кардиопулмонарни (сърдечно-белодробни) усложнения, свързани със седацията;
- рядко и летален изход;
Рисковите фактори за перфорация по време на диагностичната колоноскопия включват:
- напреднала възраст;
- наличие на дивертикулоза (състояние, при което от стената на дебелото черво се оформят торбовидни разширения, наречени дивертикули);
- женски пол
- анамнеза за тазова/коремна хирургия;
Диагностичната колоноскопия носи риск от усложнения, който е около 0.1%, докато полипектомията значително увеличава риска за перфорация до 0.2% и 1% за кървене.
Диференциална диагноза
Диференциалната диагноза на аденоматозните полипи се прави с:
- аденокарцином на колона;
- полипи;
- фамилна аденоматозна полипоза;
- чревна лейомиосаркома;
- липоми;
- синдром на Peutz-Jeghers (Пойтц-Йегерс);
- ректален карцином;
Лечение
Ексцизия и пълно отстраняване на аденоматозна тъкан по време на колоноскопия се счита за средство на избор при лечение, като целта на лечението е да намали риска за развитие на рак на дебелото черво (CRC). Използват се няколко техники за отстраняване на полип, включително клещовидна биопсия (биопсия форцепс) или примка (с или без електрокаутеризация).
Когато се извършва en-bloc (анблок) отстраняване на полип, има възможност да се прецени каква е дълбочината на проникване на туморните клетки и дали оперативните ръбове са засегнати. Злокачествените полипи на краче лесно се отстраняват с помощта на LEEP-процедура. Въпреки това, тази техника често води и до премахване на парчета тъкан, когато се прилага за неподвижни и плоски злокачествени полипи. Около една трета от злокачествените полипи се отстраняват по този начин.
En-bloc отстраняването дава предимство, тъй като позволява пълна хистологична (тъканна) оценка при пълна резекция и се свързва с по-ниска честота на рецидивите в сравнение с фрагментирано (на отделни части) отстраняване.
Случаите с неинвазивна високостепенна неоплазия (NHGN), независимо от тяхната морфология, се лекуват посредством полипектомия.
Указанията за злокачествените полипи, които са на краче, независимо от наличието на благоприятни хистологични критерии, е операция, особено при пациенти, които са по-млади от 50 години и които желаят по-малко хирургични усложнения.
Ендоскопската субмукозна дисекция (ESD) е особено полезна за отстраняването на неподвижни или плоски аденоматозни заболявания. Този подход е показан за полипи, които:
- са по-големи от 2-3 см;
- засягат повече от две трети от обиколката на дебелото черво;
- са с плоска морфология;
Методът дава възможност за лечение на големи (> 2 см) полипи, които са плоски или са с краче, като позволява патологична оценка и лечение на повечето пациенти. ESD е по-добрия метод в сравнение с конвенционалната ендоскопска мукозна резекция, защото позволява по-обемна резекция и повишена вероятност за излекуване, въпреки по-дългото време, необходимо за извършване на процедурата. Освен това, ESD може да бъде алтернативен метод за операция при по-възрастните пациенти, както и при хора, чието състояние не позволява оперативна намеса. Този тип резекция трябва да се обмисля за приложение при злокачествени полипи без краче, независимо от хистологичните критерии.
От съществено значение е патологът да идентифицира крачето или дълбочината на диатермичното изгаряне. Рискът от рецидив варира от 0% до 2% при злокачествените полипи с резекционни ръбове, по-големи от 1 мм. Когато резекционните ръбове също са засегнати или са по-малки от 1 мм, честота на рецидивите варира между 21% и 33%.
Преди самото отстраняване на полип е трудно да се разбере дали този полип е злокачествен или не. Преди резекция е необходимо да се маркира основата на полипа, което ще помогне на хирурга при манипулацията.
Независимо от морфологичните характеристики, полипите обикновено се отстраняват, когато се открият. Полипектомията би трябвало да се извърши анблок, тъй като това е от съществено значение за установяването и определянето дали хистологичните критерии са благоприятни или не.
Само в много редки случаи се извършва единствено биопсия на полипа, като това може да се дължи на:
- липса на конкретни данни, позволяващи електрокоагулация;
- невъзможност за отстраняване на полипа в този времеви интервал;
- пациентът приема антитромбоцитни лекарства или антикоагуланти;
Обикновено няма нужда от отворена хирургична намеса при лечението на аденоматозни полипи. Хирургично лечение се препоръчва за злокачествени полипи на краче, които имат неблагоприятни хистологични критерии:
- частична резекция на полип;
- слабо диференциран карцином;
- съдова или лимфна инвазия;
- резекционен ръб < 2 мм;
- дълбочината на субмукозната инвазия е < 3 мм от muscularis mucosae;
При педункулираните злокачествени полипи, но с благоприятна хистологична характеристика, полипектомията се смята за средство на лечение.
Рядко, голям аденом (> 2 см) на широка основа може да не бъде податлив на ендоскопска резекция и може да изисква операция.
Други лезии могат да изискват лапароскопия или лапаротомия (оперативно отваряне на коремната кухина) със сегментна резекция на дебелото черво и оценка на лимфните възли.
Трансаналната ендоскопска микрохирургия (ТЕМ) е минимално инвазивна хирургична техника, която позволява на хирурга да оперира в средната и горната част на ректума, без да е наложително да се направи разрез през корема. ТЕМ е нискорискова манипулация, която дава малко усложнения — локалните рецидиви са по-малко от 10%.
В случаи на неинвазивна високостепенна неоплазия (NHGN) и злокачествени полипи на краче, както и благоприятни хистологични критерии, се препоръчва да се направи колоноскопия три месеца след вземане на биопсичен материал. Ако изследванията са нормални, по-нататъшни изследвания се препоръчват след една, три и пет години.
Ако резултатите в рамките на три месеца са отрицателни, последващия мониторинг (наблюдение) трябва да е като този, приложен при пациенти с доброкачествени аденоми, тъй като няма доказателства, че такива пациенти са изложени на по-висок риск за развитие на метахронни (развиващи се в различни интервали от време) полипи или карциноми, в сравнение с пациентите с доброкачествени аденоми.
Проучванията показват, че 11.8% от пациентите, които са претърпели полипектомия, развиват метахронни напреднали аденоми, а 0.6% — инвазивен карцином.
Известни са случаи на злокачествени педункулирани полипи с неблагоприятни хистологични критерии, при които не са открити остатъчни карциноми в чревната стена или засягането на лимфни възли, но са открити далечни метастази при последващото проследяване, дори пет години след операцията.
По-нататъшно стационарно лечение рядко се изисква за диагностика и лечение на аденом. Гъвкавата сигмоидоскопия и колоноскопия като цяло са амбулаторни процедури.
Интервалите между отделните колоноскопии зависи от размера, броя и хистологичния тип на полипа, както и фамилната анамнеза.
Честота на рецидивите при полипи е приблизително 20% на петата година и около 50% след 15 година, като честотата на рецидивите е по-висока при пациенти с множество полипи.
Скрининг и проследяване
Съществуват множество възможности за скрининг при колоректалните полипи и рака на дебелото черво при пациенти с умерен риск, включително изследване на изпражнения (FOBT, FIT), образна диагностика (ВЕ, КТ-колонография), както и ендоскопски изследвания (FS, колоноскопия).
FOBT и FS са показани за намаляване на смъртността при колоректален карцином, но колоноскопията се очертава като доминиращ скринингов метод.
При високорисковите пациенти се прилага скрининг и проследяване с колоноскопия.
Индивидите с умерен риск трябва да започнат със скрининга на 50-годишна възраст. При лицата, на които не е открита колоректална неоплазия при първоначалната скринингова колоноскопия, повторен скрининг се препоръчва след 10 години.
За тези, които имат 1-2 малки аденоми (< 9 мм), повторна колоноскопия се препоръчва след 5-10 години.
За тези, които са с аденом, който е по-голям от 1 см, имат 3 или повече аденоми от всякакъв размер или аденом с напреднала хистология (вилозна характеристика, високостепенна дисплазия), колоноскопията трябва да се повтаря през 3 години.
При пациенти, при които не се откриват аденоми при колоноскопия, повторен скрининг се препоръчва след 10 години. За тези с 1–2 малки аденоми (< 9 мм) се препоръчва колоноскопия след 5-10 години. За тези с аденом по-голям от 1 см, с 3 или повече аденоми от всякакви размери или аденоми с напреднала хистология, колоноскопията трябва да се повтаря през 3 години.
Колоноскопията трябва да се повтори в рамките на 6 месеца, ако лигавицата не е адекватно визуализирана (лоша подготовка на червата, непълна колоноскопия) или ако високорискова лезия е отстранена (голям полип, частична резекция), за да бъде сигурно, че целия полип е бил отстранен.
Пациентите, диагностицирани с аденоми, които не са правилно проследени с повтарящи се колоноскопии, имат повишен риск от развитие на метахронни аденоми и/или колоректален рак.
Придържането към програмите за скрининг и наблюдение на аденомите се очаква значително да намали риска от развитие на рак на дебелото черво.
Химиопрофилактика със сулиндак е показана за значително намаляване на броя и размера на аденомите при пациенти с фамилна аденоматозна полипоза (FAP). Селективният инхибитор на циклооксигеназа-2 (COX-2) — целекоксиб — също е доказано, че причинява умерена регресия (обратно развитие) на аденомите на дебелото черво при пациенти с FAP.
Поради опасения, породени от страничните им ефекти, нестероидните противовъзпалителни средства (НСПВС) в момента не се препоръчват за лечение или профилактика на спорадични аденоми на дебелото черво при пациенти с умерен риск.
Усложнение
Основното усложнение, свързано с аденоми, е потенциалното развитие на колоректален карцином. По-малко от 5% от всички аденоми прогресират до рак, като рискът от развитие на рак се увеличава с увеличаването на размера, вилозния компонент и степента на дисплазия.
Библиография
https://www.ncbi.nlm.nih.gov/books/NBK65880/
Коментари към Карцином in situ на колон МКБ D01.0