Строеж на имуноглобулините
Антителата (имуноглобулините) са белтъци, които принадлежат към гама-глобулиновата фракция. Те се произвеждат от плазматичните клетки при антигенен стимул.
Строеж на имуноглобулините
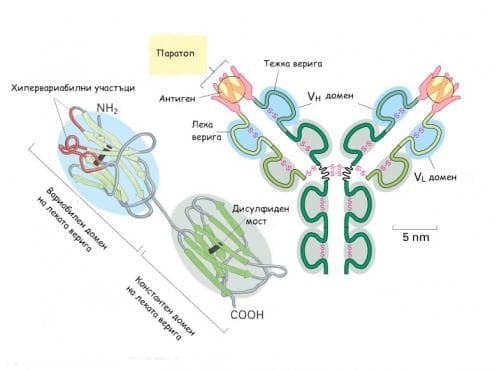
Всеки имуноглобулин съдържа поне една основна структура, наречена мономер. Мономерът е съставен от четири полипептидни вериги - две леки L (light) и две тежки H (heavy), които са свързани с около 20-25 дисулфидни връзки между цистеиновите участъци. Дисулфидните връзки могат да са разположени междуверижно - между H- и L-веригите или вътреверижно, оформяйки домените на отделните вериги. Структурата на мономера на имуноглобулините наподобява латинската буква Y. Различните имуноглобулини притежават различен брой мономери, а общата формула на антителата е (H2 L2)n. Леките вериги съдържат 214 аминокиселини, а в тежките вериги техният брой е около два пъти повече - около 440. Имуноглобулините всъщност са гликопротеини, защото към тежките им вериги са прикрепени няколко олигозахаридни вериги.
Леки и тежки вериги
 Леките вериги могат да бъдат два типа капа (κ) и ламбда (λ). За тежките вериги са възможни следните варианти гама (γ), алфа (α), мю (μ), делта (δ) и епсилон (ε). Това определя и петте класа имуноглобулини според типа на Н-веригите: IgG, IgA, IgM, IgD, IgE. Всеки клас имуноглобулини може да има само идентичен тип леки вериги или капа (κ), или ламбда (λ) и съответния тип тежки вериги. Антителата са пример за белтъци с четвъртична структура, съставени от 4 белтъчни вериги. IgG е съставен само от един мономер, но IgA може да е мономер, димер или тример. IgМ е пентамер - съставен е от 5 мономера и следователно има най-много активни центрове - 10. При полимерните имуноглобулини IgM и IgA има свързваща J-верига. Тази верига съдържа 137 аминокиселини с голямо количество цистеин, което обяснява възможността за създаване на много дисулфидни мостове за свързване между веригите.
Леките вериги могат да бъдат два типа капа (κ) и ламбда (λ). За тежките вериги са възможни следните варианти гама (γ), алфа (α), мю (μ), делта (δ) и епсилон (ε). Това определя и петте класа имуноглобулини според типа на Н-веригите: IgG, IgA, IgM, IgD, IgE. Всеки клас имуноглобулини може да има само идентичен тип леки вериги или капа (κ), или ламбда (λ) и съответния тип тежки вериги. Антителата са пример за белтъци с четвъртична структура, съставени от 4 белтъчни вериги. IgG е съставен само от един мономер, но IgA може да е мономер, димер или тример. IgМ е пентамер - съставен е от 5 мономера и следователно има най-много активни центрове - 10. При полимерните имуноглобулини IgM и IgA има свързваща J-верига. Тази верига съдържа 137 аминокиселини с голямо количество цистеин, което обяснява възможността за създаване на много дисулфидни мостове за свързване между веригите.
Полипептидният участък с терминална аминогрупа образува вариабилната (V) зона със силно вариращ аминокиселинен състав в отделните молекули, който участват в образуването на антиген-свързващото място (паратоп), а участъкът с карбоксилна група представлява константната област (С) със сравнително постоянен аминокиселинен състав. При леките вериги двете области са еднакви по дължина, докато в тежките вериги константната област е три пъти по-дълга и формира пространствена структура от три константни домена. При вариабилната област се наблюдава един варибилен домен. Ограничен участък на вариабилната зона, съставен от малко на брой аминокиселини, се характеризира с висока вариабилност на състава и се нарича хипервариабилен участък. Тези участъци са по 3 за всяка верига. Именно това са участъците, които оформят активния център (паратопа) на антителата. Особеностите на строежа на имуноглобулините показват, че всяка имуноглобулинова молекула има поне два активни центъра и е двувалентна, с два антиген-свързващи участъка.
Структура на имуноглобулините
- Първична структура – тя се определя от аминокиселинната последователност на вариабилните области на леките и тежките вериги.
- Вторична структура – тя представлява нагъването на антилелата до образуване на глобуларни структури, наречени домени. Домените са сегменти, съставени от около 110 аминокиселини. Всяка лека верига образува два домена, а тежката – четири.
- Третична структура – тя се изразява в промяна на структурата на домена, като той придобива форма на цилиндър, изграден от два белтъчни слоя, които са свързани по между си с дисулфидна връзка.
- Четвъртична структура – обуславя се от наличието на повече от една полипептидна верига. При имуноглобулините, които са полимери (IgA, IgM), се наблюдава свързването на мономерите чрез J-вериги. Тези вериги за никомолекулни гликопротеини, които са прикрепени, към тежките вериги.
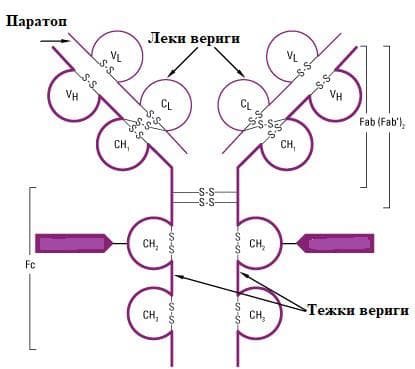
 Антителата принадлежат към имуноглобулиновата суперфамилия. Към тази група спадат и други белтъци, които участват в механизмите на междуклетъчна сигнализация. Проучването на имуноглобулините е осъществени благодарение на ензимите папаин и пепсин. Под действие на папаина молекулата на IgG се разкъсва на два Fab-фрагмента и един Fc-фрагмент, чрез разрушаване на първите две дисулфидни връзки. Под действие на пепсина се получават един Fab-фрагмент и един Fc-фрагмент. Така е установено, че Fab-фрагментът съдържа цялата лека верига, както и вариабилният и първият константен домен на тежката, а Fc-фрагментът съдържа константните домени на тежката верига.
Антителата принадлежат към имуноглобулиновата суперфамилия. Към тази група спадат и други белтъци, които участват в механизмите на междуклетъчна сигнализация. Проучването на имуноглобулините е осъществени благодарение на ензимите папаин и пепсин. Под действие на папаина молекулата на IgG се разкъсва на два Fab-фрагмента и един Fc-фрагмент, чрез разрушаване на първите две дисулфидни връзки. Под действие на пепсина се получават един Fab-фрагмент и един Fc-фрагмент. Така е установено, че Fab-фрагментът съдържа цялата лека верига, както и вариабилният и първият константен домен на тежката, а Fc-фрагментът съдържа константните домени на тежката верига.
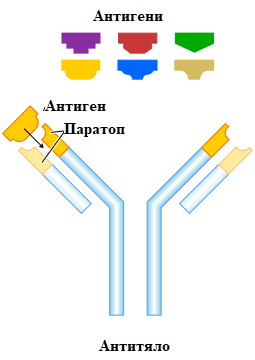
Паратоп (антиген-свързващ участък на антителата)
Всеки мономер, изграждащ имуноглобулиновата верига, притежава два паратопа. По тази причина той се нарича двувалентен. Понякога монемирите могат да бъдат и едновалентни, когато функционира само единият антиген-свързващ участък. Паратопът представлява цепнатина със строго специфична форма и състав.
Продукти свързани със СТАТИЯТА
КОЛАСТРА капсули * 90 SANCT BERNHARD
МУРАКОЛ ПРОТЕКТ прах 120 г
МУРАКОЛ ПРОТЕКТ прах 360 г
Безплатна доставка за България!ТЕРНИМАКС капсули * 120
МУРАКОЛ ПРОТЕКТ КИДС прах 120 г
ВИТАУЪРЛД КОЛАСТРА капсули 400 мг * 60
ПРОМОБиблиография
https://www.thermofisher.com/bg/en/home/life-science/antibodies/antibodies-learning-center/antibodies-resource-library/antibody-methods/immunoglobulin-structure-classes.html
https://biochemistryquestions.wordpress.com/2009/05/26/immunoglobulins-structure-and-functions/
http://www.namrata.co/structure-and-function-of-immunoglobulins/
https://www.uptodate.com/contents/structure-of-immunoglobulins
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3670108/
http://www.microbiologybook.org/mobile/m.immuno-4.htm
Виктория Сарафян и съавтори, „Медицинска биология”, Пловдив-2010
СТАТИЯТА е свързана към
- Имунна система
- Придобит имунитет
- Имуноглобулини
- Имунохистохимия
- Микрозомални антитела (МАТ)/Антитела срещу тиреоидната пероксидаза (Anti-TPO)
- Сауна: лечебни ефекти, ползи и рискове
- Манука
- Диета №15 - общовъзстановяваща
- Изследване на антитела (имуноглобулини)
- Хидрастис
- Мирта
- Лимфни възли
- Сироп от черен бъз - полезни свойства и приготвяне у дома







Коментари към Строеж на имуноглобулините