Механизми на резистентност към отделните групи противомикробни препарати
Антибиотиците и другите противомикробни препарати представляват една от най-успешните форми на терапия в медицината. Ефективността на тези лекарствени средства се компрометира от възникването на все по-голям брой устойчиви на антибиотици болестотворни микроорганизми. Резистентността към антибиотици е свързана с повишена заболеваемост и смъртност от заразни заболявания, както и с повишаване разходите за лечението им, което се счита за една от основните глобални заплахи за общественото здраве.
Механизмите на резистентност, чрез които бактериите изграждат защита срещу увреждащото действие на противомикробните препарати, представляват огромен интерес за микробиолози и клиницисти. По-доброто разбиране на тези механизми създава условия за разработване на противомикробни средства, които потенциират ефикасността и увеличават живота на антибиотиците, като същевременно се сведе до минимум появата на антибиотична резистентност.
Механизми на резистентност към отделните групи противомикробни препарати - бета-лактами и гликопептиди
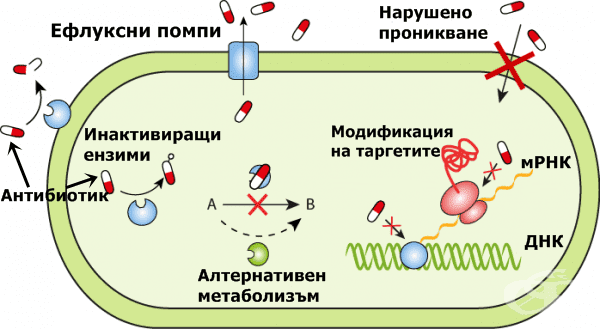
Бета-лактамните антибиотици, които инхибират биосинтезата на бактериалната клетъчна стена, са най-разпространените лекарствени средства, използвани за лечение на множество инфекции, причинени от Грам-положителни и Грам-отрицателни бактерии. Вследствие на широката им и в много случаи неоправдана употреба редица бактериални видове развиват резистентност. Тя се реализира посредством следните механизми:
- образуване на ензими - бета-лактамази, които хидролизират бета-лактамния пръстен в молекулата на антибиотика и го инактивират;
- модификация или синтез на нови пеницилин свързващи протеини на цитоплазмената мембрана, водещо до понижаване на афинитета им към бета-лактамите;
- нарушаване инфлукса (навлизането) на антибиотика през външната мембрана на определени Грам-отрицателни прокариоти (напр. P. aeruginosa);
- инактивиране на муреин-хидролазната система, което предпазва от разрушаване пептидогликана на бактериалната клетъчна стена.
Най-важният механизъм на антибиотична резистентност към β-лактамните антибиотици е синтезата на β-лактамазни ензими - пеницилинази, цефалоспоринази, оксицилинази, карбапенемази и др., които ги инактивират. Тези ензими се продуцират от различни представители на Грам-негативните и Грам-позитивните бактерии и се характеризира с различна хидролитична активност, специфичност към определени антибиотици и генетична обусловеност. Хромозомно-медиираните бета-лактамази, който се образуват от някои ентеробактерии и псевдомонади, както и плазмидно-кодираните широкоспектърни β-лактамази (ESBL) в клебсиелите и други Грам-отрицателни представители представляват голям клиничен интерес поради трудностите, който поставят пред терапията на причинените от тях инфекции.
Един от подходите за противодействие на устойчивостта към β-лактамни антибиотици е откриването и внедряването в клиничната практика на нови съединения, които потискат β-лактамазната функция. След обширни изследвания през последните три десетилетия са получени т.нар. β-лактамазни инхибитори (напр. калвулонова киселина, сулбактам), които се комбинират с пеницилинови и цефалоспоринови антибиотици за лечение на инфекции, дължащи се на β-лактамазопродуциращи бактериални щамове. Въпреки успешното развитие на комбинираната терапия с инхибитори на β-лактамазите, използването им невинаги носи желания ефект поради променливият афинитет на инхибиторите към различните β-лактамази и огромното количество ензими, които се произвеждат от резистентните щамове. За да се реши този проблем и да се оптимизира съществуващата терапия на базата на β-лактамни антибиотици, се получават нови молекули (напр. литична трансгликозилаза), които инхибират индукцията на β-лактамазите като атакуват ключови съединения, необходими за активирането тези ензими.
Резистентността към гликопептидните антибиотици (ванкомицин, тейкопланин) е значително по-рядко срещана и се отнася предимно за представители на род Enterococcus и коаголазонегативни стафилококи. Дължи се на ензима D-аланин-D-аланин лигаза, който участва в синтезта на D-аланаин-D-лактаза с намален афинитет към гликопептидите. Устойчивостта е плазмидно- или хромозомно-медиирана и може да бъде предавана вътревидово, междувидово, както и между родово - от ентерококи към стафилококи.
Механизми на резистентност към отделните групи противомикробни препарати - аминогликозиди и тетрациклини
Аминогликозидините и тетрациклиновите антибиотици са отделни групи противобактериални съединения с различна химична структура, но със сходен механизъм на действие - потискат протеиновата синтеза в бактериалните клетки като атакуват 30S рибозомната субединица. Устойчивостта към тези препарати е обусловена от различни хромозомно- или плазмидно-медиирани модификации на таргетните структури, променен мембранен пермеабилитет и синтеза на инактивиращи ензим.
Клинично значимите механизми на резистентност към аминогликозидите са два:
1. Инактивиране на аминогликозида посредством синтезата на специфични ензими (аденил-, ацетил-, фосфотрансферази), които прибавят към молекулата му различни радикали. Този механизъм е плазмидно-обусловен и се среща при Грам-негативни и Грам-позитивни бактериални представители. Характерно е, че един ензим може да модифицира различни аминогликозиди, на което се дължи и кръстосаната резистентност към този клас антибиотици.
2. Вторият механизъм е свързан с промяна в проницаемостта на бактериалните клетъчни мембрани, което затруднява проникването на аминогликозида в клетката и препятства неговото действие в цитоплазмата. Характерен е за някои Грам-отрицатени бактерии, затрудняващо лечението на причинените от тях инфекции.
През последните десетилетия се провеждат проучвания относно възможностите за противодействие на устойчивостта към аминогликозидите. Една от основните насоки в това отношение е откриването на съединения, които да потиснат активността на ензими, модифициращи тези антибиотици. В момента са открити инхибитори на аминогликозид фосфотрансферазата, но те все още не намират приложение в клиничната практика.
Устойчивостта към тетрациклиновите антибиотици се дължи на модифицирани мембранни протеини, които увеличвата извеждането (ефлукс) им от бактериалните клетки. Промяната в тези транспортни система медиирани от хромозомни или плазмидни мутации. Вторият важен механизъм на резистентност към тетрациклините е свързан с мутантен цитоплазмен протеин, който намалява афинитета на рибозомната 30S субединица към тези медикаменти.
Механизми на резистентност към отделните групи противомикробни препарати - макролиди, линкозамиди, стрептограмини
Макролидите, линкозамидите и стрептограмините са групи от лекарствени молекули с антибактериална активност, които инхибират белтъчния синтез в бактериалните клетки като блокират 23S рРНК на 50S рибозомната субединица. Основен механизъм на резистентност към тези противомикробни средства е метилирането на 23S рРНК, което препятства свързването на антибиотика към 50S субединицата. Наблюдаваната кръстосана устойчивост е предимно плазмидно обусловена. Други механизми на резистентност са наличие на ефлуксни системи (при резистентни щамове стафилококи) и инактивиращи ензими (фосфотрансфераза при сем. Ентеробактерии). Резистентността към хлорамфеникола, атакуващ 50S субединицата, се дължи на плазмидно- или хромозомно-опосредствана ацетилтрансфераза, която го инактивира, както и на активния му ефлукс от устойчивите щамове.
Механизми на резистентност към отделните групи противомикробни препарати - антифолатни съединения, хинолони, рифамицини
Основните механизми на антибиотична устойчивост към антифолатите са свързани със синтезата на плазмидно-медиирана мутантна дихидроптероатсинтетаза, която не се повлиява от сулфонамидите, и мутантна дихидрофолатредукатаза - нечувствителна към триметоприм. Към последният е установена и първична или придобита устойчивост, свързана с намален пермеабилитет на микробните обвивки за този медикамент.
Бактериите, резистентни на хинолони и по-новите флуорохинолони, развиват устойчивост посредством два основни механизма:
1. Хромозомно-медиирани замени на аминокиселини в А субединиците на ДНК гиразата, кодирани от мутантни gyr гени. Сходни мутации са открити и в гени, кодиращи топоизомераза IV на устойчиви щамове гонококи, S. auerus и E. coli.
2. Модифицирани външномембранни протеини, които са фенотипна изява на хромозомни мутации в кодиращите ги гени. Тези протеини улесняват извеждането на химиотерапевтика (ефлукс) от бактериалните клетки на някои Грам-отрицателни представители и стафилококи.
Резистентността към рифамицините се дължи на хромозомни мутации в гени, които кодират аминокиселинния състав на бета-субединицата на ензима РНК-полимераза. Замяната на аминокиселините на бета-субединицата в резултат на настъпилите мутациите намалява афинитета на рифамицините към мястото им на свързване към посочения ензим. Подобни мутации настъпват често, поради което тези антибиотици не се прилагат самостоятелно при лекуваните с тях инфекции.
Механизми на резистентност към отделните групи противомикробни препарати - антимикотици и противовирусни медикаменти
Устойчивостта към антимикотиците (противогъбични лекарства) се осъществява чрез промяна или намаляване съдържанието на стероловите съединения в цитоплазмената мембрана на гъбичките. Това намалява свързването им към тази структура и съответно препятства токсичния им ефект.
Резистентността към антивирусните препарати е многостранна и често се дължи на голямата изменчивост на вирусите и лесно настъпващите мутации в техния геном. Така например устойчивостта на човешкия херпесен вирус тип I (HSV) към ацикловир е свързана с мутации на гени, кодиращи вирусната тимидин киназа или ДНК полимераза. Резистентността на грипния А вирус към ремантадин се дължи на замяна на една аминокиселина във вирусния M2 протеин.
При лечение на хепатит Б се използват нуклеозидни и нуклеотидни аналози, чиито таргет е генът на вирусната (HBV) полимеразата. Ензимът има четири функционални домейна (терминален протеин, спейсър). При резистентните щамове настъпват мутации в домейните на обратната транскриптаза на гена на вирусната полимераза, като повечето замествания се срещат в домените В, С и D. Устойчивостта на ХИВ (HIV-1) вируса към азидотимидин, се развива поради непълно потискане на вирусната репликация.
Установяването на мерки, които целят ограничаване резистентността към противомикробните лекарствени средства, е една от основните цели на СЗО и правителствата по света. Такива мерки са:
- регламентирано приложение на противомикробни препарати в лечебната практика и заведения;
- ограничено използване на ефективните медикамент и използването им при специфични случаи;
- контрол и надзор върху разпространението на резистентните щамове, особено в клинична обстановка;
- мониториране на антибиотичната чувствителност и периодична ротация на използваните в болнични заведения протибактериални средства;
- разработване на регионални и национални антибиотични политики за ограничаване появата и разпространението на устойчиви бактериални видове;
- откриването на нови антимикробни средства и установяване на стратегии за удължаване на полезния живот на съществуващите антибиотици;
- ограничаване злоупотребата с антибиотици сред населението.
Библиография
https://en.wikipedia.org/wiki/Beta-lactamase
https://en.wikipedia.org/wiki/Antimicrobial_resistance
https://www.researchgate.net/publication/271904028_Mechanisms_of_antibiotic_resistance
https://en.wikipedia.org/wiki/Beta-lactamase
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2871161/
https://www.ncbi.nlm.nih.gov/pubmed/11810493
https://www.ncbi.nlm.nih.gov/pubmed/11498380
Микробиология - Медицинско издателство "АРСО" София 2000
Коментари към Механизми на резистентност към отделните групи противомикробни препарати