Буферни системи
Поддържането на постоянно рН е от ключово значение за правилното функциониране на всички органи и системи. Постоянството на Н+ в телесните течности се поддържа, благодарение на три механизма, които предпазват от възникване на ацидоза и алкалоза. Тези три механизма са:
- буферни системи на организма – те реагират мигновено с кисели или алкални продукти и не допускат големи отклонения в концентрацията на свободните Н+;
- дихателна регулация на рН – чрез промяна на честотата и дълбочината на дишането се променя степента на елиминиране на СО2 от организма, което води до нормализиране на концентрацията на Н+ в телесните течности;
- бъбречен механизъм на регулация на рН – при промени в концентрацията на Н+, бъбреците променят количеството екскретирани кисели и алкални продукти с урината.
Механизмите, които участват в поддържането на постоянната концентрация на Н+ в организма, от една страна осъществяват свързването на свободните Н+, а от друга отстраняването им.
Буферни системи и буфериране
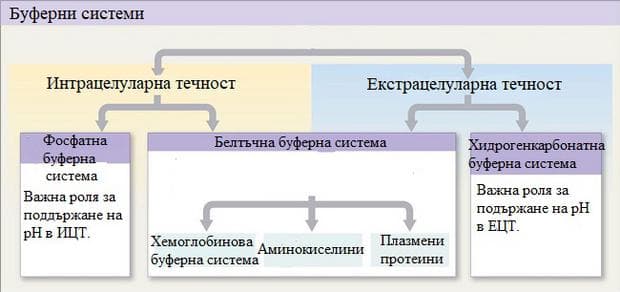
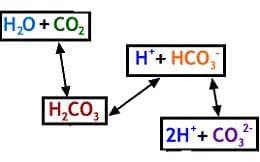
 Буферните системи са изградени от две или повече химични съединения. Те предпазват от големи промени в концентрацията на Н+, когато към разтвора се прибавят киселини или основи. Обикновено една буферна система се състои от слаба киселина и нейната алкална сол – съединение, което е в състояние да освобождава Н+ когато концентрацията им започне да намалява и друго, което може да свързва Н+, когато концентрацията им започне да се увеличава. Такава е хидрогенкарбонатната буферна система. Тя от изключително значение за регулация на алкално-киселинното равновесие в организма. Съставена от Н2СО3 и NaНСО3. Ако към тази буферна система се добави силна основа се получава алкална сол. По този начин рН на средата почти не се променя.
Буферните системи са изградени от две или повече химични съединения. Те предпазват от големи промени в концентрацията на Н+, когато към разтвора се прибавят киселини или основи. Обикновено една буферна система се състои от слаба киселина и нейната алкална сол – съединение, което е в състояние да освобождава Н+ когато концентрацията им започне да намалява и друго, което може да свързва Н+, когато концентрацията им започне да се увеличава. Такава е хидрогенкарбонатната буферна система. Тя от изключително значение за регулация на алкално-киселинното равновесие в организма. Съставена от Н2СО3 и NaНСО3. Ако към тази буферна система се добави силна основа се получава алкална сол. По този начин рН на средата почти не се променя.
NaOH + H2CO3 -> NaHCO3 + H2O
Добавянето на силна основа води до образуване на въглеродна киселина. Тя е много слаба киселина и степента и на електролитна дисоциация е много малка. Н2СО3 се дисоциира на Н+ и НСО3-. Във всеки разтвор на въглеродна киселина произведението от Н+ и НСО3-, разделено на концентрацията на недисоциираната въглеродна киселина е равно на константа.
HCl + NaHCO3 -> H2CO3 + NaCl
(H+) x (HCO3-)/(H2CO3) = K’, където К’ е дисоциационна константа
Количеството недисоциирана въглеродна киселина е пропорционално на количеството въглероден диоксид, образувана при нейното разграждане. Така от горното уравнение се получава:
(H+) x (HCO3-)/(CO2) = K
(H+) = K x (CO2)/(HCO3-)
При логаритмуване на двете страни на уравнение и умножението им по -1 се получава:
-log(H+) = -logK + log (HCO3-)/(CO2)
pH = pK + log(HCO3-)/(CO2)
рК е тази стойност на рН, при която концентрациите на киселината и нейната алкална сол са равни по между си. Буферите са най-ефикасни в среда, в която рН е в граници +/- 1 от тяхната стойност на рК. За хидрогенкарбонатната буферна система рК е равно на 6,1.
pH = 6,1 + log (HCO3-)/(CO2)
Това е уравнението на Хендерсон-Хаселбах за хидрогенкарбонатната буферна система. Ако са известни стойностите на НСО3- и СО2 по него може да се изчисли рН. При увеличаване на концентрацията на НСО3- рН се увеличава (алкалоза), а при увеличаване на концентрацията на СО2, рН намалява. Концентрацията на въглеродния диоксид може да се променя в зависимост от промени в белодробната вентилация, а концентрацията на НСО3- може да се регулира от бъбреците. Следователно двата основни фактора, които определят буфериращата сила на дадена буферна система, са концентрациите на елементите на системата и степента на съвпадение на рК на буферната система с актуалното рН, в която тя функционира. Буфериращата сила е най-голяма когато рК е равно на рН или когато съотношението на концентрациите на елементите в системата е 1:1.
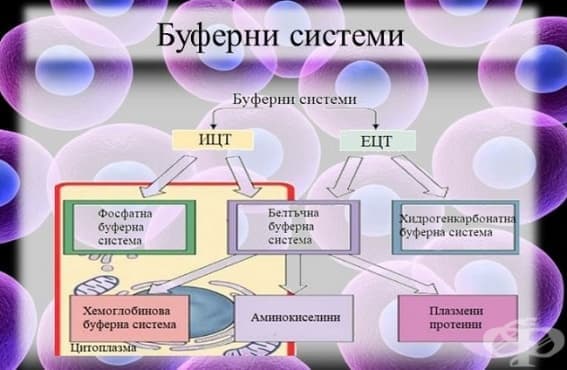
Буферните системи в телесните течности са:
- хидрогенкарбонатна буферна система;
- фосфатна буферна система;
- белтъчна буферна система;
- хемоглобинова буферна система.
Буферирането се извършва както екстрацелуларно, така и интрацелуларно, като значителна част от него се извършва в клетките на органите.
Хидрогенкарбонатна буферна система
 Хидрогенкарбонатната буферна система е изградена от въглеродна киселина, бикарбонатен йон и въглероден диоксид. рК на хидрогенкарбонатната буферна система е 6,10, а рН на артериалната кръв 7,40. При тези условия концентрацията на хидрогенкарбонатните йони е 20 пъти повече в сравнение с тази на въглеродната киселина. По тази причина буфериращата сила на хидрогенкарбонатната буферна система е слаба. Въпреки това значението на хидрогенкарбонатната буферна система за регулиране на алкално-киселинното равновесие на организма е особено голямо, защото концентрацията на всеки един от нейните елементи подлежи на регулация. Така например концентрацията на въглеродния диоксид се регулира от дишането, а концентрацията на хидрогенкарбонатните йони от бъбреците. Хидрогенкарбонатната буферна система е основният екстрацелуларен буфер за буфериране на промени в концентрацията на свободните Н+, причинени от кисели продукти. Ако се увеличи концентрацията на Н+ без да има промяна във въглеродния диоксид буферирането се извършва с участието на хидрогенкарбонатната буферна система. Тя не може да буферира промени в концентрацията на Н+ в екстрацелуларната течност причинени от промяна в концентрацията на въглеродния диоксид. Хидрогенкарбонатната буферна система е с по-голяма буферираща сила за неутрализиране на киселини в сравнение с основи.
Хидрогенкарбонатната буферна система е изградена от въглеродна киселина, бикарбонатен йон и въглероден диоксид. рК на хидрогенкарбонатната буферна система е 6,10, а рН на артериалната кръв 7,40. При тези условия концентрацията на хидрогенкарбонатните йони е 20 пъти повече в сравнение с тази на въглеродната киселина. По тази причина буфериращата сила на хидрогенкарбонатната буферна система е слаба. Въпреки това значението на хидрогенкарбонатната буферна система за регулиране на алкално-киселинното равновесие на организма е особено голямо, защото концентрацията на всеки един от нейните елементи подлежи на регулация. Така например концентрацията на въглеродния диоксид се регулира от дишането, а концентрацията на хидрогенкарбонатните йони от бъбреците. Хидрогенкарбонатната буферна система е основният екстрацелуларен буфер за буфериране на промени в концентрацията на свободните Н+, причинени от кисели продукти. Ако се увеличи концентрацията на Н+ без да има промяна във въглеродния диоксид буферирането се извършва с участието на хидрогенкарбонатната буферна система. Тя не може да буферира промени в концентрацията на Н+ в екстрацелуларната течност причинени от промяна в концентрацията на въглеродния диоксид. Хидрогенкарбонатната буферна система е с по-голяма буферираща сила за неутрализиране на киселини в сравнение с основи.
Фосфатна буферна система
Фосфатната буферна система е съставена от примерен 20% (NaH2PO4) и секундарен 80% (Na2HPO4) натриев фосфат. При добавяне на киселина системата реагира със секундерния фосфат: HCl + Na2HPO4 <-> NaH2PO4 + NaCl. Така силната киселина се заменя с примерния натриев фосфат, който е слаба киселина и рН се променя незначително. При добавяне на силна основа тя реагира с примерния натриев фосфат NaOH + Na2HPO4 <-> Na2HPO4 + H2O. Получава се секундарен натриев фосфат и рН на средата почти не се променя. Фосфатната буферна система има рК 6,80. Количеството на елементите на фосфатната буферна система в ЕЦТ е 1/12 от това на хидрогенкарбонатната. По тази причина нейната обща буферираща способност е по-малка от тази на хидрогенкарбонатната буферна система. Фосфатната буферна система има много важна роля в интрацелуларната течност, защото нейната концентрация е значително по-висока от екстрацелуларната система. Фосфатната буферна система има голямо значение за буфериране на свободните Н+ в тубулната течност.
Белтъчна буферна система
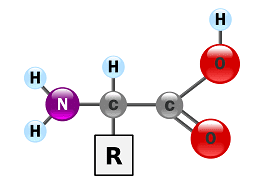 Белтъчната буферна система е изградена от плазмените и клетъчните протеини. Те са ефективни буфери, защото могат да се свързват както кисели така и алкални продукти и да неутрализират тяхното действие. Белтъците могат да свързват и да отделят Н+:
Белтъчната буферна система е изградена от плазмените и клетъчните протеини. Те са ефективни буфери, защото могат да се свързват както кисели така и алкални продукти и да неутрализират тяхното действие. Белтъците могат да свързват и да отделят Н+:
R-COOH <-> R-COO- + H+
Недисоциираната карбоксилна група може да се отделя, а дисоцииралата да свързва Н+. Другата буферна система е амониевата.
R-NH3+ <-> R-NH2 + H+
R-NH3+ е киселина, която отдава Н+, а R-NH2 е основа, която приема Н+. рК на белтъчната буферна система съвпада с актуалното рН на кръвта. По тази причина тя има два пъти по-голям буферен капацитет от хидрогенкарбонатната буферна система. Белтъчната буферна система е от ключово значение за поддържане на алкално-киселинното равновесие в клетките поради изключително високата концентрация на белтъци в тях. Дифузията на Н+ и на НСО3- през мембраната на клетките е слаба, докато СО2 преминава лесно през клетъчната мембрана. В течение на няколко часа рН на интрацелуларната течност се доближава до рН на екстрацелуларната. Буферните системи с известно забавяне подпомагат за буферирането на ЕЦТ.
Хемоглобинова буферна система
 Хемоглобинът обхваща 80% от буферния капацитет на кръвта. При пренасянето на въглероден диоксид от тъканите до белите дробове, в еритроцитите се образува въглеродна киселина. Хемоглобинът буферира Н+ получени при дисоциирането и. Хемоглобинът има огромен буферен капацитет. По тази причина венозната кръв е съвсем по-малко кисела от артериалната.
Хемоглобинът обхваща 80% от буферния капацитет на кръвта. При пренасянето на въглероден диоксид от тъканите до белите дробове, в еритроцитите се образува въглеродна киселина. Хемоглобинът буферира Н+ получени при дисоциирането и. Хемоглобинът има огромен буферен капацитет. По тази причина венозната кръв е съвсем по-малко кисела от артериалната.
|
Буферна система |
рК |
Основна функция |
|
Хидрогенкарбонатна |
6,10 |
Буферира промени в концентрацията на Н+ несвързани с промени в СО2 |
|
Фосфатна |
6,80 |
Важен буфер на ИЦТ и на урината |
|
Белтъчна |
7,40 |
Основен буфер на ИЦТ и на плазмата |
|
Хемоглобин |
80% буферен капацитет в кръвта |
Буферира основно промени в концентрацията на Н+ в резултат на промени на СО2 |
Буферните системи представляват първата защитна линия на организма срещу промени в концентрацията на Н+. При промяна те се включват незабавно и за части от секундата намаляват до минимум промените в рН. Те не могат да елиминират Н+ от организма, а единствено не допускат наличие на свободни Н+ в телесните течности. Елиминирането на Н+ се осъществява от дихателната и бъбречната регулация на рН.
Продукти свързани със СТАТИЯТА
БАЗЕН ВОДОРАСЛИ капсули * 60
АЛКАМИН pH БАЛАНС ПУДРА 150 г ХЕРБАМЕДИКА
КОНДИЦИЯ ЛЕНТИ ЗА ИЗМЕРВАНЕ НИВОТО НА КИСЕЛИННОСТ /PH/ * 80
ТЕСТ ЛЕНТИ ЗА ИЗМЕРВАНЕ НА PH В УРИНАТА * 99
ТЕСТ ЛЕНТИ ЗА ИЗМЕРВАНЕ НА PH В УРИНАТА И СЛЮНКАТА * 100
АЛКА СОЛИ ЗА ВАНА 275 г
Библиография
https://en.wikibooks.org/wiki/General_Chemistry/Buffer_Systems
https://socratic.org/questions/what-are-the-three-major-buffer-systems-of-the-body-and-how-do-they-work
https://opentextbc.ca/anatomyandphysiology/chapter/26-4-acid-base-balance/
Л. Витанова, Р. Гърчев; „Физиология на човека”; издателство АРСО
Arthur C. Guyton, M.D., John E. Hall, Ph.D.; „Text book of Medical Physiology“
СТАТИЯТА е свързана към
- Физиология на бъбреците
- Регулация на алкално-киселинното равновесие
- Алтернативно лечение на анемия
- 10 храни, богати на желязо, за повишаване на хемоглобина
- Хемоглобин (Hb)
- КАКВО Е ЕРИТРЕМИЯ?
- Пълна кръвна картина (ПКК)
- Циметидин
- Изследване на желязо в кръвта
- Избягване на киселинни храни
- Регулация на алкално-киселинното равновесие
- Бяла акация, Бял салкъм






Коментари към Буферни системи