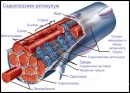
Строеж на мускулната клетка
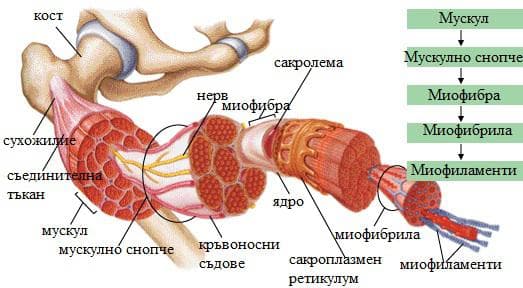
Мускулите са активната част на опорно-двигателната система. Те осигуряват придвижването на тялото и неговите части в пространството и поддържането на позата. Мускулите се делят на скелетни, гладки и на сърдечен мускул. Скелетните мускули са напречнобанраздени и са под контрол на соматичната нервна система. Тяхното съкращение е волево. Скелетните мускули, както и останалите два вида мускули притежават свойствата възбудимост, проводимост, съкратимост. Свойството съкратимост е специфично за мускулната тъкан и зависи от наличието на определени клетъчни органели. Клетките на скелетните мускули се наричат миофибри. Те са многоядрени и са образувани от сливането на множество отделни клетки. Миофибрите са групирани в отделни мускулни снопчета, които образуват целия мускул. При наблюдение под микроскоп се вижда, че миофибрите са изградени от множество микровлакна – миофибрили. Миофибрилите са изградени от още по-тънки нишки, наречени миофиламенти.
Миофибрили
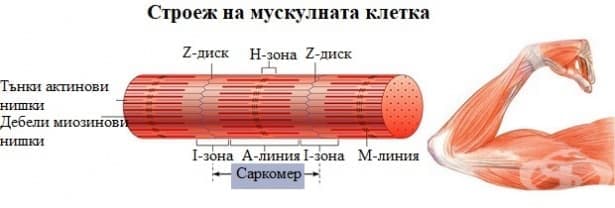
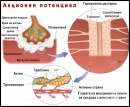
Миофибрилите са тънки и дълги нишки, чиято дължина е равна на дължината на миофибрата. Броят им варира от 50 до 5000 в зависимост от дебелината на мускулното влакно. По дължината на миофибрилата се редуват светли и тъмни напречни ивици. Светлата ивица се нарича изотропна (I-ивица), а тъмната – анизотропна (А-ивица). От своя страна I-ивицата е разделена на две половини от една тънка линия, наречена Z-линия. А-ивицата също е разделена на две половини от М-линията. Напречният срез на миофибрилата има приблизително кръгла форма. По тази причина Z-линията се нарича още Z-диск. Той представлява дебела и многослойна структура, изградена от няколко вида белтъци – α-актинин и други. Z-дисковете на съседните миофибрили са свързани помежду си чрез нишковидния белтък десмин. Това осигурява подреждането на едноименните ивици на едно и също ниво.
Оказва се, че всяка една миофибрила е сноп от последователно подредени и редуващи се миофиламенти. Това специфично подреждане на миофиламентите изгражда една повтаряща се структура по дължината на миофибрите. Тази структура се нарича саркомер. Саркомерът представлява участъкът разположен между два съседни Z-диска. Той включва една А-ивица и една половинка от I-ивиците. Саркомерите, изграждащи една миофибрила, са хиляди и са подредени последователно. Дължината им зависи от състоянието на мускула. Тя варира в тесни граници в зависимост от това дали мускула е съкратен или е в състояние на покой.
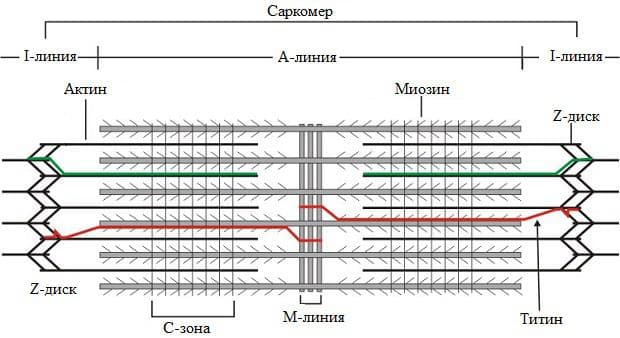
Саркомерът е изграден от белтъци, които се делят на три групи:
- съкратителни – те развиват силата, която се стреми да намали дължината на саркомера. Съкратителни белтъци са актинът и миозинът.;
- регулаторни – към тях спадат тропомиозин и тропонин;
- структурни белтъци – те участват в запазването на нормалната структура на саркомера и в изграждането на Z-диска и М-линията. Към тях спадат белтъците титин и α-актинин. Титинът е един от белтъците с най-голямо молекулно тегло в организма. Той е основната съставка в изграждането на скелета на мускулната клетка. До голяма степен титинът определя нейните пасивни еластични свойства и подреждането на останалите филаменти.
Съкратителните, регулаторните и част от структурните белтъци изграждат нишки, наречени миофиламенти. Те се визуализират само с електронен микроскоп, защото са 100 пъти по-тънки от миофибрилите.
Миофиламенти
Всеки саркомер е изграден от два вида миофиламети – тънки и дебели нишки. Те са разположени по надлъжнaта ос на миофибрилата и частично се припокриват.
Тънки (актинови) нишки
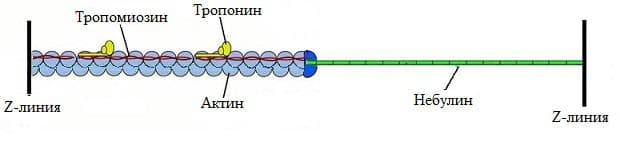
Тънките нишки са изградени от няколко вида съкратителни, структурни и регулаторни белтъци. Най-важният е съкратителният белтък актин. Останалите протеини са структурният белтък небулин и регулаторните – тропомиозин и тропонин. Количеството на актина е най-голямо и по тази причина тези нишки се наричат актинови.
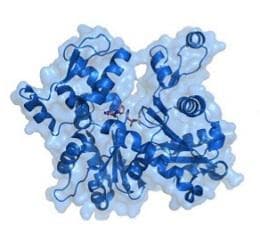 Актинът е фибриларен белтък. Актиновата молекула представлява многократно нагъната единична полипептидна верига, изградена от 375 аминокиселини. Тя има неправилна яйцевидна форма. Молекулата има два полюса, като е прието единият да се отбелязва с плюс, а другият с минус. Положителният полюс на една актинова молекула може да се свързва с отрицателния на друга актинова молекула. В молекулата на актина има и по едно залавно място за тропомиозина, тропонина и миозина. Един от участъците на актиновата молекула притежава висок афинитет за свързване с миозина. По тази причина, той се означава като активен център. При свързването на 220-240 актинови молекули се получава една актинова верига, наречена F-актин.
Актинът е фибриларен белтък. Актиновата молекула представлява многократно нагъната единична полипептидна верига, изградена от 375 аминокиселини. Тя има неправилна яйцевидна форма. Молекулата има два полюса, като е прието единият да се отбелязва с плюс, а другият с минус. Положителният полюс на една актинова молекула може да се свързва с отрицателния на друга актинова молекула. В молекулата на актина има и по едно залавно място за тропомиозина, тропонина и миозина. Един от участъците на актиновата молекула притежава висок афинитет за свързване с миозина. По тази причина, той се означава като активен център. При свързването на 220-240 актинови молекули се получава една актинова верига, наречена F-актин.
Небулинът е структурен фибриларен белтък, който се разполага по цялата дължина на двойната актинова спирала. Вероятно той служи като шаблон за определяне на дължината на актиновата верига, тъй като всички тънки нишки в един саркомер имат еднаква дължина.
Регулаторните белтъци са тропомиозинът и тропонинът. Тропомиозинът е тънък белтък, който е изграден от две полипептидни алфа-спирали. При покой на мускула тропомиозинът се намира в близост до активните центрове на актина (местата с голям афинитет за свързване на миозина). Тропомиозинът има дълга молекула, която се разполага върху седем молекули G-актин и блокира техните активни центрове.
Тропонинът е другият регулаторен белтък. Той се състои от три субединици, които се наричат тропонин-І (Тн-І), тропонин-Т (Тн-Т) и тропонин-С (Тн-С). Тн-Т субединицата се залавя за тропомиозиновата молекула, Тн-I се залавя за актина, а Тн-С не прави контакт нито с тропомиозина, нито с актина. Субединицата Тн-С може да свързва калциеви йони. Свързването на калциеви йони към нея води до конформационна промяна в тази субединица, което води до промени след себе си в другите субединици. Броят на тропониновите молекули в една актинова нишка е равен на броя на тропомиозиновите. Свързаните тропонин и тропомиозин се означават като тропомиозин-тропонинов комплекс.
Всяка една тънка нишка е изградена от около 450 актинови молекули, около 60 тропомиозин-тропонинови комплекси и от 2 молекули небулин. G-актинът е полярна структура с положителен и отрицателен край. Отрицателният край е покрит от глобуларният протеин тропомодулин, а положителният от белтък. Актиновите нишки стърчат перпендикулярно на Z-диска.
Дебели (миозинови) нишки
Дебелите нишки са съставени от белтъка миозин. Той е истински съкратителен белтък, който може да трансформира химичната връзка на АТФ в механична работа. В една миофибрила има от 400 до 1000 дебели нишки в зависимост от дебелината и. Те оформят А-ивицата на саркомера или с други думи заемат средната част на саркомера и двата им края винаги са еднакво отдалечени от Z-дисковете. Всяка миозинова нишка е заобиколена от 6 актинови. Миозинът в различните организми има различна структура. Този, който се среща в скелетните мускули, се означава като миозин II. Молекулата му се състои от две еднакви половини, като всяка една половина съдържа една голяма тежка верига и две по-малки леки вериги. Тежката верига образува главата на миозиновата молекула. Цялостната молекула е изградена от две глави, една дълга суперспирала, образувана от алфа-спирали, и четири леки вериги. Главата на миозиновата молекула е мястото, където се трансформира химичната енергия на АТФ в механична работа. В структурата на миозиновата глава се намират три важни участъка:
- участък, който се свързва с активния център на АТФ;
- ензимът аденозин трифосфатаза (АТФаза);
- участък, наречен генератор на сила – той променя структурата си и огъва главата спрямо шийката след разграждането на АТФ до АДФ и фосфат.
Дебелата нишка се състои от две напълно еднакви половини, всяка от които е изградена от основна част и връх. В състава на една дебела нишка влизат около 300 молекули миозин II.
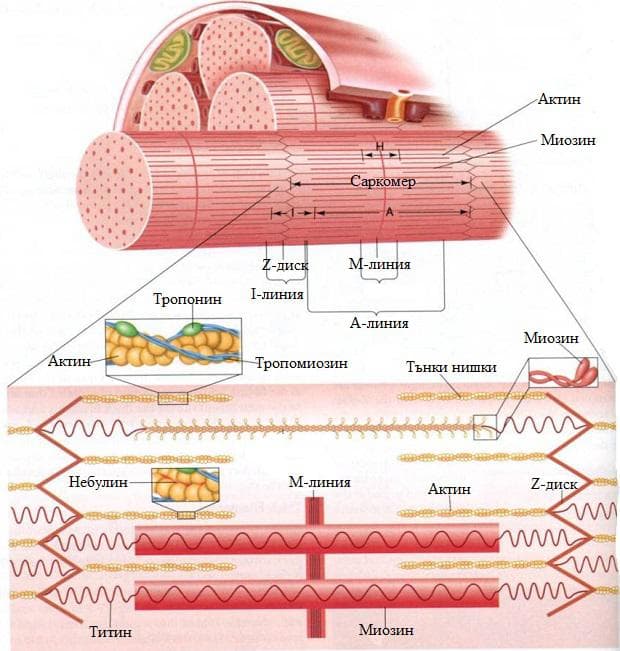
Титин
 Титинът е основният структурен белтък на миофиламентите. Той представлява много дълъг фибриларен белтък. Неговата полипептидна верига е най-дългата известна до сега. С единия си край той е прикрепен към М-линията, а с другия за основата на тънката нишка в близост до Z-мембраната. Молекулата на титина се разделя на две части. Едната част преминава по цялата дължина на дебелата нишка, а другата се простира от върха на дебелата нишка до основата на тънката. Титинът изпълнява следните функции:
Титинът е основният структурен белтък на миофиламентите. Той представлява много дълъг фибриларен белтък. Неговата полипептидна верига е най-дългата известна до сега. С единия си край той е прикрепен към М-линията, а с другия за основата на тънката нишка в близост до Z-мембраната. Молекулата на титина се разделя на две части. Едната част преминава по цялата дължина на дебелата нишка, а другата се простира от върха на дебелата нишка до основата на тънката. Титинът изпълнява следните функции:
- спомага за запазването на нормалната структура на саркомера;
- отговаря за възникването на пасивните еластични сили.
Тази сложна структура на миофиламентите обуславя механизма на мускулното съкращение. Благодарение на нея се получава скъсяване на мускула вследствие на промяна на взаимното разположение на актиновите спрямо миозиновите нишки.
Подраздели на Строеж на мускулната клетка
Продукти свързани със СТАТИЯТА
ЕНТЕРОСАН МС ПЛЮС таблетки 360 мг * 60
ТермолабилниОППО СТАБИЛИЗАТОР ЗА САКРО-ЛУМБАЛНАТА ОБЛАСТ / ПОЯС С МЕТЕЛА / модел 2164 размери S, M, L, XL, XXL
СТАБИЛИЗАТОР ЗА САКРО-ЛУМБАЛНАТА ОБЛАСТ / ПОЯС размери S, M, L, XL, XXL, XXXL ВИСОЧИНА 22 см модел 2264
ШИНА КОНТРОЛИРАЩА ОБЕМА НА ДВИЖЕНИЯТА В КОЛЯННАТА СТАВА - ДЪЛЖИНА 55 см. модел 4039 , универсален размер
Безплатна доставка за България!ШИНА КОНТРОЛИРАЩА ОБЕМА НА ДВИЖЕНИЯТА В ОБЛАСТТА НА КОЛЯНОТО модел 4139 , универсален размер
Безплатна доставка за България!СУОНСЪН МЕМБРАНА ОТ ЯЙЧЕНИ ЧЕРУПКИ капсули 500 мг * 30
Библиография
http://www.lamission.edu/lifesciences/lecturenote/AliPhysio1/Muscles.pdf
http://muscle.ucsd.edu/musIntro/fibril.shtml
https://www.britannica.com/science/myofilament
Л. Витанова, Р. Гърчев; „Физиология на човека”; издателство АРСО
доц. Янков; "Физиология"
Arthur C. Guyton, M.D., John E. Hall, Ph.D.; „Text book of Medical Physiology“
СТАТИЯТА е свързана към
- Физиология на мускулите
- Напречнонабраздени мускули
- Домашно лечение при възпаление на мускулите
- Упражнения срещу остеопороза за всеки ден
- Термофор (грейка)
- Алтернативна терапия на пареза и парализа
- Разтежение на коремните мускули в спорта
- Лечение с баклофен
- НЕВРАЛНА МУСКУЛНА АТРОФИЯ
- Набиране на лост
- Кинезио лента – японското изобретение срещу ставни и мускулни болки
- Травми на мускули и сухожилия




Коментари към Строеж на мускулната клетка