Биосинтеза на имуноглобулините
Имуноглобулините, познати още като антитела, се състоят от четири полипептидни вериги - две идентични леки (L) вериги, съставени от около 240 аминокиселинни остатъка и две идентични тежки (Н) вериги с приблизително 440 до 600 аминокиселинни остатъка. Всяка L-верига се състои от два домена с приблизително еднакъв размер. Крайният N-домен е с променлива аминокиселинна последователност и е различен във всяка отделна L-верига. С-крайният домен е с постоянна последователност. Въпреки че С-домена е с константна последователност, са познати две негови разновидности, които проявяват висока степен на хомология. Те са известни като К и Х и едната или другата (но не и двете) може да бъде намерена в имуноглобулиновата молекула. Н-веригата обикновено се състои от четири домена (или пет в някои видове имуноглобулини), всеки с около 110 аминокиселинни остатъка. Познати са пет типа H- вериги. N-терминалният домен е с променлива последователност и участва с N-крайния (променлив) домен на L-веригата, при формирането на антиген-свързващото място, от които има две молекули за всеки имуноглобулин. Малка по размер област, обикновено състояща се от около 20 аминокиселинни остатъка между втория и третия домен, се нарича шарнирна област. Подробни проучвания на множество L-вериги показват, че вариабилността на последователността е ограничена главно до три участъка от веригата, всяка съдържаща от 7 до 11 аминокиселинни остатъка. Н-веригите също имат региони с висока вариабилност, притежаващи от 5 до 16 аминокиселинни остатъка. Тези области са известни като хипервариабилни, те са разположени близо един до друг в триизмерната структура на молекулите, където образуват джоб, за който се смята, че е мястото на комбиниране.
Триизмерната структура на имуноглобулините е наблюдавана чрез рентгенова кристалография, протеините на Bence Jones (които са димери на L-вериги и се произвеждат в излишък при миеломатоза) кристализират по-лесно от целите имуноглобулинови молекули и затова са по-подходящи за този вид научно наблудение. Техните две области (VL и CL) се виждат ясно като компактни структури с къса полипептидна верига между тях. Всяка област има характерна подредба на антипаралелни 13-нагънати листа, известни като "имуноглобулинова гънка". Тя се състои от два слоя, единият съдържа три дължини на нагънатия лист.
Имуноглобулините се синтезират в плазматични клетки, наречени В-лимфоцити. Плазматичните клетки са професионални секреторни клетки, които функционират като клетъчни фабрики за имуноглобулинов синтез и секреция. Като единствен клетъчен тип, отговорен за секрецията на антитела, те играят съществена роля в имунния отговор срещу широк спектър от патогени. Тъй като плазмените клетки имат дълъг живот и могат да секретират голямо количество антитела, техният брой и вида на синтезираните от тях имуноглобулини трябва да бъдат строго регулирани. Нарушаването на тяхната хомеостаза може да доведе до тежки заболявания като имунодефицит или множествен миелом.
Изчислено е, че човешкият организъм генерира около 10 милиарда различни антитела, всеки от които е способен да свърже отделен епитоп. Въпреки че в един индивид се генерира огромен репертоар от различни антитела, броят на наличните гени за получаване на тези протеини е ограничен от размера на човешкия геном. Разработени са няколко комплексни генетични механизма, които позволяват на В-клетки от гръбначно животно да генерират разнообразен набор от антитела от сравнително малък брой гени.
Променливост на домена
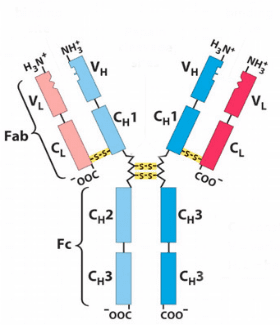 Хромозомната област, която кодира антитялото е голяма и съдържа няколко отделни генни локуса (места) за всеки домен на антитялото - хромозомният участък, съдържащ гени на тежка верига (IGH) се намира на хромозома 14, а локусите, съдържащи гени на ламбда и капа леки вериги ( IGL и IGK) се откриват върху хромозоми 22 и 2. Един от тези домени се нарича променлив домен, който присъства във всяка тежка и лека верига на всяко антитяло, но може да се различава в различните антитела, генерирани от различни В-лимфоцити. Разликите между променливите домени са разположени върху три контура, известни като хиперпроменливи области (HV-1, HV-2 и HV-3) или определящи комплементарността области (CDR1, CDR2 и CDR3). CDRs се поддържат в рамките на променливите области чрез консервативни рамкови региони. Локусът на тежката верига съдържа около 65 различни гени на вариабилен домен, всички от които се различават по техните CDR. В резултат на комбинацията на тези гени с гени за други участъци на антитялото образува голямо разнообразие от антитела с висока степен на специфичност. Тази комбинация се нарича V(D)J рекомбинация.
Хромозомната област, която кодира антитялото е голяма и съдържа няколко отделни генни локуса (места) за всеки домен на антитялото - хромозомният участък, съдържащ гени на тежка верига (IGH) се намира на хромозома 14, а локусите, съдържащи гени на ламбда и капа леки вериги ( IGL и IGK) се откриват върху хромозоми 22 и 2. Един от тези домени се нарича променлив домен, който присъства във всяка тежка и лека верига на всяко антитяло, но може да се различава в различните антитела, генерирани от различни В-лимфоцити. Разликите между променливите домени са разположени върху три контура, известни като хиперпроменливи области (HV-1, HV-2 и HV-3) или определящи комплементарността области (CDR1, CDR2 и CDR3). CDRs се поддържат в рамките на променливите области чрез консервативни рамкови региони. Локусът на тежката верига съдържа около 65 различни гени на вариабилен домен, всички от които се различават по техните CDR. В резултат на комбинацията на тези гени с гени за други участъци на антитялото образува голямо разнообразие от антитела с висока степен на специфичност. Тази комбинация се нарича V(D)J рекомбинация.
Соматичната рекомбинация на имуноглобулини е позната също като V(D)J рекомбинация и се състои в образуването на уникален имуноглобулинов участък. Областта притежаваща способността да променя аминокиселинниата си последователност на всяка имуноглобулинова тежка или лека верига е кодирана в няколко части - известни като генни сегменти (подгени). Тези участъци се наричат V, D и съединяващи (J) сегменти. V, D и J сегментите се намират в имуноглобулиновите тежки вериги, а V и J сегменти се откриват и в имуноглобулиновите леки вериги. Съществуват множество копия на V, D и J генните сегментия които са разположени тандемно в геномите на бозайниците. В костния мозък всяка развиваща се В-клетка придобива имуноглобулинов вариабилен участък чрез случайно подбиране и комбиниране на един V, един D и един J генен сегмент (или един V и един J сегмент в леката верига). Тъй като има множество копия от всеки тип генни сегменти и различни комбинации от генни сегменти могат да бъдат използвани за генериране на всяка имуноглобулинова променлива област, този процес генерира огромен брой антитела, всеки с различни паратопи.
След като В-клетка произведе функционален имуноглобулинов ген по време на V(D)J рекомбинация, тя не може да експресира друга променлива област (процес, известен като алелно изключване), така че всяка В-клетка може да произвежда антитела, съдържащи само един вид променлива верига.
Соматична хипермутация и афинитетно узряване
След активиране В-клетките започват процес на бързо деление. В тези бързо делящи се клетки гените, кодиращи променливите домени на тежките и леките вериги, претърпяват висока степен на точкова мутация чрез процес наречен соматична хипермутация (SHM). Като следствие, всяка дъщерна В-клетка ще придобие леки аминокиселинни разлики в променливите домени на техните антитяло вериги.
Това служи за увеличаване на разнообразието на групата от антитела и влияе на антиген-свързващия афинитет на антитялото. Някои точкови мутации ще доведат до производството на антитела, които имат по-слабо взаимодействие (нисък афинитет) с техния антиген, отколкото оригиналното антитяло, а някои мутации ще генерират антитела с по-силно взаимодействие (висок афинитет). В-клетките, които експресират антитела с висок афинитет на повърхността си, ще получат силен сигнал за оцеляване по време на взаимодействия с други клетки, докато тези с ниско афинитетни антитела няма и ще умрат от апоптоза. По този начин, В-клетките, експресиращи антитела с по-висок афинитет към антигена ще изпреварват тези с по-слаб афинитет за функция и оцеляване, позволявайки средния афинитет на антителата да се увеличава с времето. Процесът на генериране на антитела с повишен афинитет на свързване се нарича афинитетно узряване.
След активиране В-клетките започват процес на бързо деление. В тези бързо делящи се клетки гените, кодиращи променливите домени на тежките и леките вериги, претърпяват висока степен на точкова мутация чрез процес наречен соматична хипермутация (SHM). Като следствие, всяка дъщерна В-клетка ще придобие леки аминокиселинни разлики в променливите домени на техните антитяло вериги. Това служи за увеличаване на разнообразието на групата от антитела и влияе на антиген-свързващия афинитет на антитялото. Някои точкови мутации ще доведат до производството на антитела, които имат по-слабо взаимодействие (нисък афинитет) с техния антиген, отколкото оригиналното антитяло, а някои мутации ще генерират антитела с по-силно взаимодействие (висок афинитет). В-клетките, които експресират антитела с висок афинитет на повърхността си, ще получат силен сигнал за оцеляване по време на взаимодействия с други клетки, докато тези с ниско афинитетни антитела няма и ще умрат от апоптоза. По този начин, В-клетките, експресиращи антитела с по-висок афинитет към антигена ще изпреварват тези с по-слаб афинитет за функция и оцеляване, позволявайки средния афинитет на антителата да се увеличава с времето. Процесът на генериране на антитела с повишен афинитет на свързване се нарича афинитетно узряване.
Превключване на класове
Превключването на изотипа или класа е биологичен процес, който се проявява след активирането на В- клетката, която позволява на клетката да произвежда различни класове антитела (IgA, IgE или IgG). Различните класове се дефинират от постоянните (С) области на имуноглобулиновата тежка верига. Първоначално, наивните В-клетки експресират само клетъчно-повърхностни IgM и IgD с идентични антиген-свързващи региони. Всеки изотип е адаптиран за отделна функция, следователно след активиране, може да се изисква антитяло с ефекторна функция IgG, IgA или IgE за ефективно елиминиране на антигена. Класното превключване позволява на различни дъщерни клетки от един и същ активиран В-лимфоцит да произвеждат антитела с различни изотипове. Само константната област на тежката верига на антитялото се променя по време на смяна на класа, променливите области и следователно антигенната специфичност остават непроменени. Така потомството на една В-клетка може да произведе антитела, всички специфични за същия антиген, но със способността да произвеждат ефекторната функция, подходяща за всяко антигенно предизвикателство. Превключването на класове се задейства от цитокини.
Превключването на класове се случва в генния локус на тежката верига чрез механизъм, наречен рекомбинация на превключване на класове (CSR). Този механизъм разчита на консервативни нуклеотидни мотиви, наречени комутационни (S) региони, открити в ДН. ДНК веригата се нарушава от активността на серия от ензими в две избрани S-области. Променливият домен екзон се свързва отново чрез процес, наречен нехомоложен краен съединител с желаната константна област. Този процес води до имуноглобулинов ген, който кодира антитяло с различен изотип.
Продукти свързани със СТАТИЯТА
ВИТАУЪРЛД КОЛАСТРА капсули 400 мг * 60
ПРОМОМУРАКОЛ ПРОТЕКТ ПЛЮС прах 120 г
МУРАКОЛ ИМУНО КОЛАГЕН прах 200 г
МУРАКОЛ ПРОТЕКТ капсули * 120
КОЛАСТРА капсули * 90 SANCT BERNHARD
МУРАКОЛ ПРОАКТИВ капсули * 120
Библиография
https://www.ncbi.nlm.nih.gov/pubmed/21329807
https://en.wikipedia.org/wiki/Antibody
https://iubmb.onlinelibrary.wiley.com/doi/pdf/10.1016/0307-4412%2882%2990003-6
СТАТИЯТА е свързана към
- Инфекция и имунитет
- Имунитет
- Антитела - структура и функция
- Изследване на антитела (имуноглобулини)
- Подсилване на имунната система - имуномодулатори
- Имуноглобулин G (IgG)
- Органични вещества в кръвната плазма
- Имуноглобулин А (IgA) антиендомизиумни антитела (EMA)
- КП № 54 ДИАГНОСТИКА И СПЕЦИФИЧНО ЛЕЧЕНИЕ НА ОСТРА И ХРОНИЧНА ДЕМИЕЛИНИЗИРАЩА ПОЛИНЕВРОПАТИЯ (ГИЛЕН-БАРЕ)
- Имуноглобулин А (IgА)
- Имуноглобулин М (IgМ)
- Имунитет
- Имуноглобулин D (IgD)






Коментари към Биосинтеза на имуноглобулините