Антитела - структура и функция
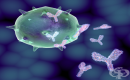
Производството на антитела е основна функция на хуморалната имунна система. Антителата представляват Y-образни протеини. Те се мобилизират от имунната система, за да идентифицират и неутрализират чуждородните за организма обекти. Те ни защитават от инфекция чрез свързване с вируси и микробни токсини, като по този начин ги дезактивират. Свързването на антителата с патогенните микроорганизми също привлича различни видове бели кръвни клетки и система от кръвни протеини. Белите кръвни клетки и активираните компоненти на комплемента работят заедно, за да атакуват нашествениците. Имуноглобулините се намират в кръвта, както и други тъкани и течности. Те се произвеждат от плазмените клетки, получени от В-клетките на имунната система.
Изследването на антителата започва през 1890 г., когато К. Шигасабуро описва активността на антителата срещу дифтерия и тетанус. По-късно Пол Ерлих да предлага теорията на страничните вериги за взаимодействието на антителата и антигените през 1897 г., когато е предположил, че рецепторите (описани като "странични вериги") на повърхността на клетките могат да се свързват специфично с токсините. Други изследователи вярват, че антителата съществуват свободно в кръвта, а през 1904 г. Алмот Райт предполага, че разтворимите антитела покриват бактериите, за да ги обозначат за фагоцитоза.През 20-те години на миналия век Майкъл Хайделбергер и Осуалд Авери наблюдават, че антигените могат да се утаяват заедно с антителата. Биохимичните свойства на антиген-антитяло свързващите взаимодействия са разгледани по-подробно в края на 30-те от Джон Марак. През 1948 г. Астрид Фагреау открива, че В-клетките са отговорни за генерирането на антитела. Основен напредък в тези структурнипроучвания е откриването на леката верига на антителата. Антителата (известни също като имуноглобулини) се използват от имунната система за неутрализиране на патогени като патогенни бактерии, вируси и други чуждородни за организма вещества.
 Антителата разпознават антигените чрез променливия регион наречен Fab фрагмент. Всяко антитяло съдържа паратоп, който е специфичен за един конкретен епитоп на антигена (подобно на съвпадението между ключ и ключалка), което позволява тези две структури да се свържат с високо ниво на прецизност. Използвайки този механизъм за свързване, антитялото може да маркира чуждороден микроорганизъм или заразена клетка и да неутрализира целта си директно (например чрез инхибиране на част от микробния метаболизъм, който е от съществено значение за неговото оцеляване). В зависимост от антигена, свързването може да попречи на биологичния процес причиняващ заболяването, или да активира макрофагите, за да унищожи чуждото вещество. Способността на антитялото да комуникира с другите компоненти на имунната система се медиира чрез неговия Fc фрагмент, който
Антителата разпознават антигените чрез променливия регион наречен Fab фрагмент. Всяко антитяло съдържа паратоп, който е специфичен за един конкретен епитоп на антигена (подобно на съвпадението между ключ и ключалка), което позволява тези две структури да се свържат с високо ниво на прецизност. Използвайки този механизъм за свързване, антитялото може да маркира чуждороден микроорганизъм или заразена клетка и да неутрализира целта си директно (например чрез инхибиране на част от микробния метаболизъм, който е от съществено значение за неговото оцеляване). В зависимост от антигена, свързването може да попречи на биологичния процес причиняващ заболяването, или да активира макрофагите, за да унищожи чуждото вещество. Способността на антитялото да комуникира с другите компоненти на имунната система се медиира чрез неговия Fc фрагмент, който
съдържа консервирано място на гликозилиране, участващо в тези взаимодействия. Въпреки че общата структура на всички антитела е много подобна, малката област в края на протеина е изключително променлива, което позволява да съществуват милиони антитела с различни антиген свързващи места. Този регион е известен като вариабилен регион. Всеки от тези варианти може да се свърже с друг антиген. Това огромно разнообразие от паратопи върху антиген-свързващите фрагменти позволява на имунната система да разпознае еднакво голямо разнообразие от антигени. Голямата и разнообразна популация от паратопи се генерира от случайни рекомбинационни събития от набор от генни сегменти, които кодират различни антиген свързващи места (или паратопи), последвани от произволни мутации в тази област на гена на антитялото, които създават допълнително разнообразие. Този рекомбинантен процес, който продуцира разнообразие от клонални паратопни антитела се нарича V или VJ рекомбинация. В основата си, паратопа на антитялото е полигенен, съставен от три гена - V, D и J. Всяка област на паратопа също е полиморфна, така че по време на производството на антитела се избира един алел от V, един от D и един от J. Тези генни сегменти след това се съединяват, като се използва произволна генетична рекомбинация, за да се получи паратопа. Районите, където гените са случайно рекомбинирани са свръх променливата област, използвана за разпознаване на различни антигени на клонална основа. Гените на антителата също се реорганизират чрез процес наречен класово превключване, който променя един вид фрагмент от тежка верига Fc в друг, създавайки различен изотип на антитялото, което запазва антиген специфичния променлив регион. Това позволява единично антитяло да бъде използвано от различни типове Fc рецептори. Свързаната с мембрана форма на антитялото се нарича повърхностен имуноглобулин (sIg) или мембранен имуноглобулин (mIg). Той е част от В-клетъчния рецептор (BCR), който позволява на В-клетките да откриват кога е налице специфичен антиген в организма и задейства активирането на В-клетките. B-клетъчния рецептор се състои от повърхностно обвързани IgD или IgM антитела и свързаните с тях Ig-? и Ig-? хетеродимери, които са способни да предават сигнал. Типичната човешка В-клетка притежава около 50 000 до 100 000 антитела, свързани към нейната повърхност. При свързване с антигени, те се групират в големи пластири, които могат да надвишават 1 микрометър в диаметър. Тези пластири могат да подобрят ефективността на клетъчния имунен отговор. Fc-медиирани ефекторни функции:
- Активиране на ефекторните клетки - Чрез техните Fc фрагменти, антителата могат да активират фагоцитиращите клетки като макрофаги и неутрофили, Т-клетките като естествените клетки убийци и еозинофили и мастоцити. Всяка от тези клетки има рецептор за Fc-фрагмента. По този начин тези клетки могат да идентифицират Fc-фрагмента и да елиминират патогените.
- Свързване с комплемента - Веднъж свързан с антигена, настъпва образуване на комплекси антиген-антитяло. Това допълнително активира комплекс от реакции, наречени каскада на комплемента. Активирането на комплемента започва, когато C1q молекулата се свързва с молекули на антителата, прикрепени към повърхността на патогена и задейства класическия път за активиране на комплемента. Основните функции на добавките са да се позволи на фагоцитите да унищожат бактериите, които иначе не биха разпознали. Нито комплементът, нито фагоцитите са специфични за патогена, но антителата са.
- Опсонизация - микроорганизмите, които се реплицират извън клетките, се отстраняват чрез взаимодействие на Fc-фрагмента със специфични рецептори на повърхността на ефекторните клетки. Антителата покриват повърхността на патогена и позволяват свързването на техните Fc домени с Fc рецепторите, присъстващи в ефекторните клетки. След това макрофагите и неутрофилите поглъщат патогена и интернализират микробите, причинявайки разрушаването му. Познати са пет класа имуноглобулини - IgM, IgG, IgA, IgD и IgE.
IgG съдържа γ тежка верига, IgM съдържа μ тежка верига, IgA - алфа тежка верига, IgD - δ тежка верига,IgE - тежка верига ε.
Подкласове на антитела:
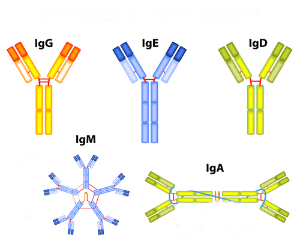 Всяка от формите има малка разлика в постоянния регион на тежката верига. Въз основа на разликите, серумните имуноглобулини се класифицират в подкласове. Те се откриват чрез серологични изследвания. Откриват се и в секрети като димер с J верига.
Всяка от формите има малка разлика в постоянния регион на тежката верига. Въз основа на разликите, серумните имуноглобулини се класифицират в подкласове. Те се откриват чрез серологични изследвания. Откриват се и в секрети като димер с J верига.
- IgA е вторият най-богат Ig в серума. Това е основният клас на Ig в секретите, т.е. в сълзи, слюнка, коластра (първоначално кърма), слуз и т.н. и е важен в мукозния имунитет. Той се свързва с PMN клетки и лимфоцити.
- IgM притежава допълнителен домен и друг протеин, ковалентно свързан чрез дисулфидна връзка. Обикновено те образуват пентамери или клъстери. Това е първият Ig, който се синтезира от плода. Той е добър аглутиниращ Ig, който води до елиминиране на микробите. Също така е в състояние да свързва някои клетки чрез Fc рецептори.
- IgD има ниски серумни нива. Той се намира главно върху повърхността на В-клетките и служи като рецептор за антигени.
- IgE е в най-малко кличество в серума. Той се свързва с Fc рецепторите на базофилите и мастоцитите преди взаимодействие с антигени. По този начин те се включват в алергичните реакции. Той играе роля при паразитни и хелминтни заболявания.
- Имуноглобулините от клас G съществуват като единични молекули. Това са най-универсалните имуноглобулини и могат да изпълняват всички функции на Ig молекулите. Откриват се в най-голямо количество в серума и в екстраваскуларните пространства. Това е единственият имуноглобулин, който преминава през плацентата.
Основната структура на всички антитела е еднаква - четири полипептидни вериги, захванати заедно чрез дисулфидни връзки. Тези четири полипептидни вериги образуват симетрична молекулна структура. В центъра се разполага шарнирна връзка между тежките вериги, за да се осигури гъвкавост на протеина. Двете леки вериги са еднакви една с друга. Те съдържат около 220 аминокиселини, докато веригите имат 440 аминокиселини. Съществуват два вида леки вериги сред всички класове имуноглобулини - ламбда верига и капа верига. И двете имат подобна функция. Всеки тип имуноглобулин има различен тип тежка верига. Антителата функционират в тялото като двуостър меч. От една страна, те защитават тялото от микроби, но от друга могат да причинят тежки алергични реакции към сравнително безвредни протеини и други молекули, присъстващи в храната, околната среда, лекарствата и др. IgE е най-важният медиатор на свръхчувствителност или алергични реакции. Когато се свързва с мултивалентни антигени, се осъществява активиране на мастоцитната клетка, която освобождава химични медиатори, съхранявани в гранули и способни да посредничат за локални инфилтрационни реакции.
Подраздели на Антитела - структура и функция
Продукти свързани със СТАТИЯТА
ВИТАУЪРЛД КОЛАСТРА капсули 400 мг * 60
ПРОМОМУРАКОЛ ПРОТЕКТ ПЛЮС прах 120 г
МУРАКОЛ ИМУНО КОЛАГЕН прах 200 г
МУРАКОЛ ПРОТЕКТ капсули * 120
КОЛАСТРА капсули * 90 SANCT BERNHARD
МУРАКОЛ ПРОАКТИВ капсули * 120
Библиография
https://en.wikipedia.org/wiki/Antibody
https://www.news-medical.net/health/What-is-an-Antibody.aspx
https://www.news-medical.net/health/Antibody-Forms.aspx
СТАТИЯТА е свързана към
- Инфекция и имунитет
- Имунитет
- Изследване на антитела (имуноглобулини)
- Органични вещества в кръвната плазма
- Имуноглобулин А (IgA) антиендомизиумни антитела (EMA)
- Подсилване на имунната система - имуномодулатори
- Имуноглобулин G (IgG)
- Имуноглобулин А (IgА)
- Имуноглобулин М (IgМ)
- Имунитет
- КП № 54 ДИАГНОСТИКА И СПЕЦИФИЧНО ЛЕЧЕНИЕ НА ОСТРА И ХРОНИЧНА ДЕМИЕЛИНИЗИРАЩА ПОЛИНЕВРОПАТИЯ (ГИЛЕН-БАРЕ)
- Имуноглобулин D (IgD)






Коментари към Антитела - структура и функция