Амилоидоза МКБ E85
Въведение
Амилоидозите са нарушения на протеиновата конформация и метаболизма, при които неразтворимите фибрили се отлагат в органите на тялото, причинявайки дисфункция на органите и в крайна сметка смърт. Приблизително 60 хетерогенни амилоидогенни протеини са идентифицирани, 27 от които са свързани с известна човешка болест. Обединяващата характеристика на тези протеини е тяхната склонност да образуват ?-плисирани листове, подравнени по антипаралелен начин. След това тези листове образуват твърди, неразклонени фибрили, които се противопоставят на протеолизата и причиняват механични смущения и локален оксидативен стрес в засегнатите органи като сърцето, черния дроб, бъбреците и стомашно-чревния тракт.
Думата „амилон“ е използвана за първи път през 1834 година от немския ботаник Матиас Шлейден, за да опише восъчното нишесте в растенията. След това Рудолф Вирхов въвежда думата „амилоид“ през 1854 година, за да опише тъканни отлагания, оцветени като целулоза, когато са изложени на йод. Патолозите вече знаят, че при използването на багрилото Конго червено, въведено през 20-те години на миналия век, амилоида изглежда розово при нормално осветление и демонстрира зелено-ябълково двойно пречупване при поляризирана светлина. Различните видове амилоиди са неразличими с помощта на светлинна микроскопия. Следователно е от съществено значение патологът да извърши допълнителни изследвания, за да определи окончателно вида на протеина, тъй като прогнозата и лечението на амилоидозата могат да варират значително в зависимост от отговорния протеин.
Преди това бяха разработени множество класификационни системи за класифициране на различни видове амилоидоза. В съвремието заболяването е класифицирано според химичния анализ на амилоидните образувания. Амилоидозата може да бъде класифицирана според системна, наследствена, централна нервна система, очна и локализирана етиология. Най-често срещаните видове обаче са AL, AA, ATTR (транстиретин на амилоиден транспортен протеин) и амилоидоза, свързана с диализа (тип бета2-микроглобулин).
При AL амилоидоза „А“ представлява амилоид, последван от свързания фибриларен протеин, „L“ означава фрагмент от лека верига или имуноглобулинова лека верига. При АА амилоидоза втората гласна "А" означава серумния амилоиден А протеин.
Епидемиология
AL амилоидозата (първична амилоидоза) има честота 1 случай на 100 000 човекогодини в западните страни. В Съединените щати има около 1275 до 3200 нови случая годишно. Годишният дял на новите случаи е 78%.
Фамилната транстиретин-свързана амилоидоза (ATTR) е по-рядко срещан системен тип амилоидоза с неизвестна честота, но приблизително 10% до 20% от диагностицираните случаи в третичните центрове са вторични по отношение на ATTR амилоидозата. От тези случаи седем процента са наследствени и са резултат от мутирал транстиретин (ATTRm) и приблизително шест процента представляват придобитата, свързана с възрастта, див тип ATTRwt амилоидоза. ATTRwt се наблюдава по-често при мъже и преди е била известна като старческа системна амилоидоза.
AA амилоидоза (вторична амилоидоза) представлява 6% от всички случаи на амилоидоза, диагностицирани всяка година. АА амилоидозата е придобит и реактивен процес поради хронично възпаление.
Етиология
Причините за възникването на амилоидозата все още са неизвестни. Най-засегнатите органи са сърцето, бъбреците, черния дроб, слезката, нервната система и гастроинтестиналния тракт. Както се вижда, заболяването обхваща редица жизненоважни органи, което го прави с изключителна значимост.
Съществуват три основни вида амилоидоза в зависимост от причината, водеща до нейната поява:
- Първична – това е най-честата разновидност на заболяването, при което първично се засягат сърцето, бъбреците, езика, нервите. Обикновено тази форма не е свързана с други заболявания, с изключение на определен вид тумор на костния мозък, наречен мултиплен миелом. Причините за възникването на първичната амилоидоза са неизвестни. Специалистите смятат, че началото на болестта е в костния мозък, където клетките започват да произвеждат не само червени, бели кръвни телца и тромбоцити, но и антитела – вид белтъчни молекули, които при нормални условия предпазват организма от възникването на редица заболявания. След като антителата изпълнят функциите си в организма те се подлагат на разграждане от специални структури на организма. Амилоидоза настъпва тогава, когато костният мозък продуцира антитела, които в последствие не могат да се разрушат. Постепенно концентрацията на тези протеини в кръвта силно нараства и те започват да се депозират в различните тъкани и органи под формата на амилоид.
- Вторична – този вид амилоидоза възниква най-често на базата на подлежащо хронично възпалително заболяване като туберкулоза, ревматоиден артрит, остеомиелит. Тук могат да се засегнат всички тъкани и органи, но най-често страдат бъбреците, черния дроб, слезката и лимфните възли. В този случай лечението на първичното заболяване, довело до патологичното натрупване на амилоид в клетките на организма, може да предотврати по-нататъшната еволюция на амилоидозата.
- Наследствена – вид амилоидоза, която се унаследява. Засягат се обикновено нервите, сърцето и бъбреците.
Рискови фактори за възникване на амилоидоза:
- Възраст – обикновено повечето пациенти с амилоидоза са над 40 години.
- Пол – мъжете страдат по-често от това заболяване.
- Други заболявания – наличието на хронична възпалителна или инфекциозна болест увеличава риска от появата на амилоидоза. Обикновено 10-15% от хората с амилоидоза имат мултиплен миелом – вид Неходжиков лимфом.
- Наследственост.
- Хемодиализа – в някои случаи тя се асоциира с диализа, свързана с амилоидоза. Причината за нейната поява е, че посредством диализата организмът не може да премахне големите белтъчни молекули от кръвта, в резултат на което те започват да се отлагат в околните тъкани.
Изследванията показват, че количеството приет с храната протеин няма отношение към възникването на заболяването. Освен това няма доказана връзка между амилоидозата и стреса.
Патофизиология
Двадесет и един различни протеини са идентифицирани като амилоидогенни агенти. Полипептидите могат да приемат алтернативни неправилно сгънати състояния, което ги прави склонни към агрегиране. Има множество процеси, при които се получава неправилно сгъване на протеинови прекурсори. Протеинът може по същество да придобие патологична конформация със стареене, както се наблюдава при пациенти с див тип транстиретин старческа системна амилоидоза. Това може да се случи и когато има висока серумна концентрация на протеинови прекурсори, както се наблюдава при пациенти на продължителна хемодиализа с повишени нива на бета-2-микроглобулин.
При наследствена амилоидоза, заместването на единични аминокиселини може да доведе до амилоидогенни неправилно сгънати протеини, които губят биологичната функция на естествените протеини и на свой ред се агрегират. Протеолитично ремоделиране на бета-амилоидни протеини прекурсори е идентифицирано при болестта на Алцхаймер. При пациенти с АА амилоидоза, серумният амилоид А, протеин с реагент в остра фаза се отлага в различни тъкани.
Амилоидогенните варианти на различните протеини-прекурсори са термодинамично по-малко стабилни, което води до дисоциация на тетрамери в мономери в случай на транстиретин и дестабилизиране на третичната структура, което води до частично нагънати конформери в случай на лизозим. Транстиретиновите мономери и лизозимните частично нагънати конформери имат склонността да се агрегират и сглобяват във фибрили. Заредените остатъци също играят роля в модулирането на агрегацията, използвайки отблъскващи сили, водещи до частично разгъване, което прави протеина податлив на атаки на протеази и освобождаването на амилоидогенни полипептиди. Такъв е случаят с гелсолин, амилоидогенен протеин, който причинява системна амилоидоза.
Ниското рН, повишените температури, ограничената протеолиза, осмолитите и металните йони могат да променят триизмерната структура на протеините, измествайки равновесието към амилоидогенно състояние. Механизмът на увреждане на тъканите при амилоидоза включва промяна на тъканната архитектура, взаимодействие с рецепторите на клетъчната повърхност, възпаление, предизвикано от отлагането на амилоиден протеин, оксидативен стрес и активиране на апоптозата.
Клинична картина
Клиничните характеристики на амилоидозата варират в зависимост от това кой тип амилоидни фибрили са отговорни. Системната амилоидоза (АА) може да доведе до сърдечна недостатъчност с хипертрофия на лявата камера на ехокардиограма със стандартна или нисковолтова електрокардиограма. Могат да присъстват хепатомегалия, нефротичен синдром, макроглосия, ортостатична хипотония, екхимоза и автономна и периферна невропатия. Синдромът на карпалния тунел, клаудикацията на челюстта и ставните отлагания на амилоид също могат да бъдат проява на системна амилоидоза.
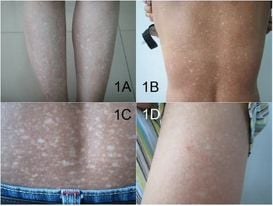
Изображение: Wenlin Yang, Yangyang Lin, Jian Yang, Wensheng Lin, CC BY 3.0
Други проявяващи се симптоми зависят от органите, които са най-силно засегнати при даден пациент. Чернодробно засягане се наблюдава при 15-25% от пациентите, невропатия при 15-20% и сърдечно засягане до 50%. Симптоматичната сърдечна недостатъчност, наблюдавана при 25-33% от пациентите, предвещава средна преживяемост под 6 месеци. Бъбречното засягане се проявява като нефротичен синдром. Засягането на стомашно-чревния тракт причинява макроглосия, диария поради малабсорбция, стомашна хипомоторика и запек. При 30% от пациентите са засегнати три или повече органа. Амилоидозата може също да причини ортостатична хипотония, хипотиреоидизъм, ретикулонодуларни инфилтрати и амилоидоми в белите дробове, плеврални изливи, възлови отлагания по кожата, лимфаденопатия и спленомегалия.
При вторична амилоидоза (АА) могат да се наблюдават хепатоспленомегалия, протеинурия, бъбречна недостатъчност и ортостаза. АТР амилоидозата започва през средната възраст и се проявява с периферна и автономна невропатия, кардиомиопатия и затъмняване на стъкловидното тяло. Амилоидната бета-амилоидоза е локализирана в централната нервна система и се проявява като спорадична болест на Алцхаймер и стареене.
Други находки от физически преглед, които могат да доведат до подозрение за амилоидоза, са хипертрофирани раменни подложки от отлагане на амилоид, амилоидна пурпура.
Диагноза
Както вече споменахме, диагнозата на амилоидозата е сравнително трудна. За това заболяване може да се мисли при откриването на повишен белтък в урината и кръвта.
Видът на амилоидния протеин може да бъде определен по различни начини:
- откриване на анормални протеини в кръвния поток (чрез протеинова електрофореза или определяне на лека верига)
- свързване на специфични антитела към амилоида, открит в тъканта (имунохистохимия)
- екстракция на протеина и идентифициране на отделните му аминокиселини
Имунохистохимията може да идентифицира вторична амилоидоза през по-голямата част от времето, но може да пропусне много случаи на първична амилоидоза. Лазерната микродисекция с масспектрометрия е най-надеждният метод за идентифициране на различните форми на амилоидоза.
Първичната амилоидоза е най-честата форма на амилоидоза и диагнозата често започва с търсене на дисплазия на плазмените клетки, В клетки от паметта, произвеждащи аберантни имуноглобулини или части от имуноглобулини. Имунофиксиращата електрофореза на урина или серум е положителна при 90% от хората с първична амилоидоза. Имунофиксиращата електрофореза е по-чувствителна от обикновената електрофореза, но може да не е налична във всички центрове. Алтернативно имунохистохимично оцветяване на биопсия на костен мозък, търсещо доминантни плазмени клетки, може да се търси при хора с високо клинично подозрение за първична амилоидоза, но с отрицателна електрофореза.
ATTR, или свързана с фамилна транстиретин амилоидоза, се подозира при хора с фамилна анамнеза за идиопатични невропатии или сърдечна недостатъчност, които нямат данни за плазменоклетъчни дискразии. ATTR може да бъде идентифициран с помощта на изоелектрично фокусиране, което разделя мутиралите форми на транстиретин. Констатациите могат да бъдат потвърдени чрез генетично изследване, за да се търсят специфични известни мутации в транстиретин, които предразполагат към амилоидоза.
Вторична амилоидоза се подозира по клинични причини при лица с дългогодишни инфекции или възпалителни заболявания. Заболяването може да бъде идентифицирано чрез имунохистохимично оцветяване.
Сигурна диагноза обаче може да се постави само след тъканна биопсия. Обикновено материалът се взима от различни тъкани и органи, като най-често това са мастната тъкан в областта на корема, костен мозък, право черво. След това взетият биопсичен материал щателно се изследва под микроскоп и с помощта на специални оцветителни техники се търси наличието на амилоид. Материалът за биопсия се изследва микроскопски и се оцветява с багрило, наречено конго червено, което ще даде зелен цвят, когато се гледа в поляризиращ микроскоп, ако има амилоид. Трябва да се спомене, че съществуват различни видове амилоид, което предполага и използването на различни способи за точната детекция на конкретния вид патологичен протеин.
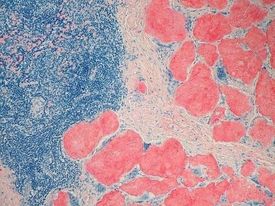
Изображение: Ed Uthman, MD, CC BY-SA 2.0
Лечение
На този етап лечение на амилоидоза няма, съществуват само различни методи с помощта, на които да се облекчат и овладеят до известна степен симптомите. Най-честото лечението на амилоидозата има за цел облекчаване и ограничаване на симптомите.
Лечението на първичната амилоидоза все още представлява предизвикателство за учените. Най-често се предлага извършването на костномозъчна трансплантация. При невъзможност за нейното извършване се прилагат различни химиотерапевтични схеми, чиято цел е унищожаване на клетките в костния мозък, водещи до повишената продукция на амилоид. Обикновено най-използваният химиотерапевтик е мелфаланът.
Целта при лечението на вторичната амилоидоза е лечение на основното заболяване, довело до отлагането на патологичен белтък в органите и тъканите.
Наследствената форма на амилоидозата се повлиява добре от чернодробната трансплантация, тъй като именно клетките на черния дроб са отговорни за синтезирането на патологичния протеин.
Заглавно изображение: CCO Public domain
Видове Амилоидоза МКБ E85
Симптоми и признаци при Амилоидоза МКБ E85
ВсичкиБиблиография
https://www.ncbi.nlm.nih.gov/books/NBK470285/
https://en.wikipedia.org/wiki/Amyloidosis#Diagnosis
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3487569/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1742163/
Коментари към Амилоидоза МКБ E85