Карцином in situ на ларинкс МКБ D02.0
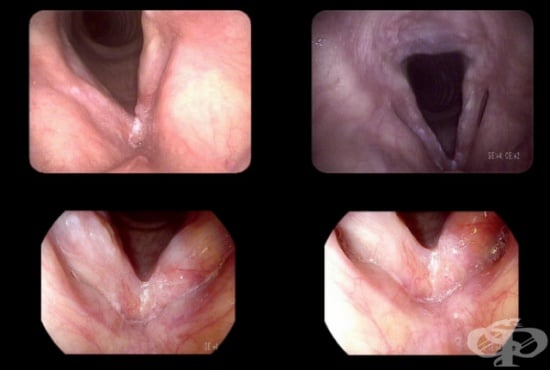
В това МКБ D02.0 Карцином in situ на ларинкс се разглеждат неинвазивните ракови изменения (карциноми in situ) на "гласовата кутия" в човешкото тяло — ларинкс.
Гръклянът — larynx, ларинкс, е не само гласов орган, но и въздухоносна тръба.
Гръклянът има хрущялен скелет, изграден от еластични и хиалинни хрущяли, които биват чифтни и нечифтни.
Нечифтните хрущяли са:
- щитовиден хрущял — cartilago thyroidea;
- пръстеновиден хрущял — cartilago cricoidea;
- надгръклянник — cartilago epiglottica;
Чифтните хрущяли биват:
- пирамиден хрущял — cartilago arytenoidea;
- рогчест хрущял — cartilago corniculata;
- клиновиден хрущял — cartilago cuneiformis;
- пшеничен хрущял — cartilago triticea;
Мукозата (лигавицата) на ларинкса — tunica mucosa laryngis — е свързана хлабаво с подлежащата й тъкан чрез lamina propria (ламина проприя), която е добре развита. В кухината на ларинкса лигавицата формира два чифта големи гънки. Горните гънки — plicae ventricularis (лъжливи гласни гънки), представляват лигавична дубликатура. Под лъжливите гласни гънки се намират истинските гласни гънки — plicae vocales. Във вътрешността на истинската гласна гънка се намират гласната връзка — ligamentum vocale, и гласовият мускул — m.vocalis.
По-голямата част от гръклянната лигавица е изградена от привидно многослоен призматичен (многореден цилиндричен) ресничест епител.
Ларингеалната кухина (cavitas laryngis) е разделена на три части:
- разстоянието от входа на ларинкса до лъжливите му гласни гънки се нарича преддверие на гръкляна — vestibulum laryngis;
- между двете лъжливи гласни гънки се загражда цепка — rima vestibuli;
- друга цепка се загражда от двете истински гласни гънки, която се нарича гласна цепка — rima glottidis или glottis;
Повече за анатомичното устройство на гръкляна ще намерите при:
Прекурсорните лезии (поражения) на ларинкса се описват като променен епител с повишена вероятност за прогресиране до плоскоклетъчен карцином (SCC). Промененият епител показва различни цитологични (клетъчни) и архитектурни (структурни) промени, които обикновено се групират под термина дисплазия (анормален растеж или развитие на тъкани, органи или клетки).
Широко прието е, че преходът от нормален епител до плоскоклетъчен карцином (SCC) на ларинкса е дълъг, сложен и многостепенен процес, свързан с постепенното натрупване на генетични промени, водещи до натрупване на трансформирани епителни клетки. Целият спектър от хистологични (тъканни) промени, настъпили при този процес, се означават като плоскоклетъчни интраепителни (вътреепителни) лезии (SIL) и обхващат измененията от плоскоклетъчна хиперплазия до карцином in situ (CIS). В някои случаи се използват и други термини, като например плоскоклетъчна интраепителна неоплазия (SIN). Рядко, злокачествена трансформация може да се развие дори от морфологично нормален епител.
Атипия не се смята за синоним на дисплазия. Атипия се използва в контекста на възпалителни и регенеративни промени и в частност — за цитологични особености.
Световната здравна организация (СЗО) определя премалигнените (предраковите) лезии на ларинкса като "морфологични изменения на лигавицата, причинени от хронични локални дразнещи фактори или дължащи се на локална експресия (изява) на общи заболявания, при които има голяма вероятност за разпад на образуванието и засягане на околната тъкан".
В своето развитие, при някои от случаите плоскоклетъчните интраепителни лезии се самоограничават и са обратими, а някои продължават да прогресират до плоскоклетъчен карцином, въпреки внимателното проследяване и лечение.
Особен интерес при SIL представляват измененията с най-висок риск за злокачествена трансформация, като тези лезии биват определяни по различен начин — потенциално малигнени (злокачествени), рискови, прекурсорни, пренеопластични или преканцерозни (предракови).
Един от основните и все още нерешен проблем, свързан с пренеопластичните лезии, остава кога и при какви условия тези лезии прогресират (ако е налице прогресия) до явно злокачествено заболяване.
Около 95% от ларингеалните злокачествени заболявания са плоскоклетъчни карциноми. По-голямата част от неоплазмите произхождат от супраглотисните и глотисните региони.
Пълният спектър на ларингеалните прекурсорни лезии се наблюдава предимно във възрастната популация и засяга по-често мъжете, отколкото жените, като това несъответствие е особено изразено след 54-годишна възраст. В последните години жените се засягат все по-често поради увеличената честота на тютюнопушене през последните две десетилетия.
Ларингеалният плоскоклетъчен карцином in situ се развива най-често в шестото и седмото десетилетие, но в някои от случаите се е появил и при деца. Средната възраст за поставянето на първоначалната диагноза при прекурсорните лезии е между 46.0-56.5 години.
Епидемиология
Приблизителната честота на тези злокачествени заболявания варира в световен мащаб и зависи от размера, вида и начина на излагане на различни канцерогени.
Честотата при мъжете е най-висока (10/100 000 годишно) в Южна и Централна Европа, Южна Бразилия, Уругвай и Аржентина. Най-ниски стойности (<1/100 000 годишно) са установени в Югоизточна Азия и Централна Африка.
Честотата при жените е под 1/100 000 годишно в повечето популации.
Честотата на HPV при ларингеалните карциноми in situ варира значително — между 0% и 54.1% — в зависимост от изследваната популация, вида на изследваната клинична проба и използвания метод за установяване на HPV.
При ларингеалните новообразувания, съдържащи HPV, се откриват предимно високорискови HPV генотипове, като най-често се среща HPV-16.
Освен при неинвазивните карциноми, ДНК на папилома вирус е открита и при значителна част (12-25%) от индивидите, при които се наблюдава клинично и хистологично нормална мукоза (лигавица) на ларинкса. Тези резултати предполагат, че наличието на HPV може да не е резултат от вирусна инфекция, а по-скоро на случайно HPV колонизиране на гръклянната лигавица.
Рискови фактори
Тютюнопушенето и злоупотребата с алкохол са основните рискови фактори, както за развитието на ларингеален карцином, така и за SIL. Комбинираното им приложение увеличава риска за развитие на злокачествено заболяване на гръкляна. Ролята на тютюнопушенето е доказано и клинично, и експериментално.
Рискът за развитие на SIL е свързан с:
- възрастта на пациента при започване на консумацията на тютюн;
- продължителността на консумацията;
- качеството на тютюна;
Някои от навиците при пушене също са свързани с повишен риск за развитие на карцином in situ на ларинкс:
- пушене в млада възраст;
- дългогодишна употреба на тютюневи изделия;
- изпушването на голям брой цигари на ден;
- дълбоко вдишване на цигарения дим;
Избягването на цигарите и алкохола могат да предотвратят около 90% от ларингеалните плоскоклетъчни карциноми ин ситу.
Има спор по отношение на професионалната експозиция на азбест и повишения риск за развитие на плоскоклетъчен карцином in situ на ларинкса, като скорошни данни не са подкрепили значението на азбеста като рисков фактор.
Налице са доказателства в подкрепа на други професионални експозиции и повишен риск за развитие на карцином in situ на ларинкс, като например:
- полициклични ароматни въглеводороди;
- метален прах;
- циментен прах;
- бои;
- лакове и др.
Нарушенията в храненето, липсата на витамини А, С и Е, обструкция (запушване) на горните дихателни пътища, хронични инфекции и хормонални смущения също участват в развитието на злокачествено заболяване на ларинкса.
Гастроезофагеалната рефлуксна болест (ГЕРБ) също е свързана с повишен риск за развитие на неинвазивен (непроникващ в съседните структури) карцином на ларинкса, особено при пациенти, при които не се наблюдават други основни рискови фактори. Гастроезофагеалният рефлукс може да се засили в присъствието на тютюн и алкохол.
Връзката на гастроезофагеалната рефлуксна болест (ГЕРБ) с ларингеалния карцином е предложена за първи път от Олсън (Olson) през 1983 г., който открил карцином на ларинкса в серия от пациенти с ГЕРБ.
Ранни изследвания показват, че човешкия папилома вирус (HPV) има етиологична роля в развитието на ларингеален карцином in situ. Тази връзка се предлага за първи път, когато в ларингеален карцином са открити типични за HPV цитопатични особености, които впоследствие са потвърдени чрез имунохистохимия и изследвани чрез използване на различни ДНК хибридизационни и амплификационни методи, предимно полимеразна верижна реакция (PCR).
Няма доказателства за влиянието на значителни генетични фактори в канцерогенезата (развитието на рак) на ларинкса. Възможно е полиморфизмът (наличието на различни форми) при някои ензими, участващи в детоксикацията на алкохол и тютюневи изделия, като например алкохолдехидрогеназа и алдехид дехидрогеназа, да бъдат слабо действащи фактори.
Синдромът на Bloom е наследствено състояние, което предразполага към развитието на плоскоклетъчен карцином in situ на ларинкса.
Класификация
Хистологичната класификация на преканцерозните лезии, която е много важна във връзка с клиничните цели, се основава на оценката на степента на хиперплазия (увеличаване на броя клетките) и/или дисплазия на епитела.
От 1923 година, когато Джаксън (Jackson) за първи път описва хроничния ларингит и кератозата (прекомерно вроговяване на епидермиса, при което той задебелява) като преканцерозни състояния, са направени многобройни проучвания и класификации с цел изучаване на фенотипните и генетичните промени, както и биологичното поведение на лезиите.
Още през 1963 г., Kleinsasser предлага една от първите ларингеални системи за класификация с подгрупи, която по-късно е допълнена от Delemarre, и при нея се разграничават няколко класа:
- клас I — обикновена плоскоклетъчна хиперплазия на клетките — характеризира се с удебеляване на епитела и с нормално узряване;
- клас II — епителна хиперплазия с атипия — налице е лека, локализирана клетъчна атипия и нарушена само до известна степен диференциация, поради което тези лезии не могат да бъдат класифицирани като премалигнени (предракови);
- клас III — карцином in situ; предраков епител;
Повечето от настоящите класификации, като например: обикновената система за дисплазия; кератоза без атипия (KWA) и кератоза с атипия/карцином in situ, сквамозна интраепителна неоплазия и ларингеална интраепителна неоплазия, следват критерии, подобни на тези, които обикновено се използват при епителните лезии на шийката на матката.
Freidmann първи предлага диспластичните лезии на ларинкса да се разглеждат по същия начин като измененията, съответстващи на тези при маточната шийка. Така, тази класификация отличава кератозата без дисплазия от:
- кератоза с лека дисплазия (ларингеална интраепителна неоплазия или LIN 1);
- кератоза с умерена дисплазия (LIN 2);
- кератоза с тежка дисплазия/карцином in stiu (LIN 3);
Класификацията, предложена в Любляна, Словения, следвана в продължение на повече от 25 години, не включва трикласовото стадиране, като е създадена, за да обхване специфичните клинични и хистологични проблеми при ларинкса.
Доказателство за неспособността на патолозите да създадат единна класификация на плоскоклетъчните интраепителни лезии е Класификацията на туморите на главата и шията (Classification of head and neck tumours) на Световната здравна организация (СЗО), публикувана през 2005 година, където са предложени три класификации:
- бинарна класификация на плоскоклетъчните интраепителни неоплазми (SIN);
- класификация на СЗО, описваща диспластичните промени (система за дисплазия);
- класификация от Любляна, Словения;
Тези класификации се различават концептуално и терминологично, като аналогията между тях може да бъде само насочваща.
Бинарната (двойната) система на SIN е създадена въз основа на специфичните критерии за разделяне на плоскоклетъчните интраепителни лезии в:
- хиперплазия/кератоза;
- SIN I (нискостепенна SIN);
- SIN II (високостепенна);
Стадият хиперплазия/кератоза се характеризира с:
- удебелен хиперпластичен епител;
- редки митози;
- ограниченост до супрабазалните (разположени над базалните) слоеве;
- налице е нормално съзряване;
- често срещана повърхностна кератинизация;
- липса на ядрен плеоморфизъм (променливост във формата, размера и оцветяването на ядрата);
При SIN I е налице:
- епителна хиперплазия;
- увеличен брой митози;
- три или повече слоеве от базалноподобни клетки;
- слабо изразен ядрен плеоморфизъм;
При SIN II може да се наблюдава:
- епителна хиперплазия;
- чести митози във всички слоеве;
- добре изразени нарушения в епителното зреене
- наличие на "базалноподобни клетки", разположени във вътрешната и средната трета;
- преждевременна кератинизация, включително наличие на кератинови перли;
- изразен ядрен плеоморфизъм;
- интензивно оцветен хроматин;
И трите степени могат да се проявят като атрофични форми.
Сравнени с класификацията от Любляна, хистологичните критерии за хиперплазия и SIN I приблизително съответстват на хистологичните критерии за плоскоклетъчна хиперплазия и базална/парабазална клетъчна хиперплазия, която се смята за доброкачествена лезия с минимален риск от злокачествена трансформация.
Хистологичните характеристики на SIN II корелират частично с атипичната хиперплазия (рисков епител) и частично с карцином in situ, включен в класификацията от Любляна.
Случаите с CIS, които отговарят на всички критерии според класификацията от Любляна, се срещат много рядко. В тези случаи трябва да се засили търсенето на възможни огнища за инвазивен карцином.
Класификацията на Световната здравна организация (СЗО) за премалигнените ларингеални лезии включва:
- хиперплазия;
- кератоза;
- дисплазия — лека, умерена или тежка;
- карцином in situ (CIS);
Много малко лезии могат да демонстрират хиперкератоза (прекомерно вроговяване на епидермиса, в резултат на което той задебелява) или паракератоза (непълно вроговяване) без да е налице клетъчен атипизъм или дисплазия.
Дисплазията представлява премалигнена (предракова) лезия на плоския епител и се характеризира със структурни нарушения, придружени от клетъчна атипия и загуба на нормална матурация (узряване) и стратификация (разслояване). Освен това, в системата за дисплазия има трудности при разпознаването на най-ранните диспластични изменения, както и затруднено разграничаване между хиперплазия и най-ранните етапи на дисплазия, а също и ясното разграничаване на дисплазията на лека, умерена и тежка.
Клетъчните изменения при леката дисплазия са незначителни и са ограничени до базалната една трета на епитела.
При умерената дисплазия се наблюдават по-ясно изразени клетъчни аномалии, включващи до две трети от епителната дебелина.
При тежката дисплазия има клетъчни аномалии, които засягат повече от две трети от епителната дебелина, в някои случаи и целия епител.
Карциномът in situ представлява интраепително новообразувание, при което цялата дебелина на сквамозния (плоския) епител показва клетъчните характеристики на карцином, но без увреждане на базалната мембрана и наличие на стромална (строма — опорната структура на орган) инвазия.
По принцип тежката дисплазия и карциномът in situ се класифицират като различни заболявания, но клинично те протичат по идентичен начин и затова могат да се разглеждат като едно състояние.
Налице е широка вариабилност в патологичното тълкуване и диагностиката, което води до субективна диагноза.
Злокачествената трансформация на леката дисплазия се наблюдава в около 11% от случаите.
Честотата на злокачествена трансформация при тежката дисплазия и карциномите in situ показва значителна изменчивост (до 45%), като 30% е общоприетата стойност. Вероятността за прогресия е свързана със степента на заболяването, като почти всички дифузни лезии демонстрират инвазивен рак, който се е развил от карцином in situ.
Въпреки че хистологичното оценяване на системата за дисплазия и класификацията от Любляна се основава на същите архитектурни (структурни) и цитологични (клетъчни) промени, не се наблюдава връзка или припокриване между двете системи за класификация. Измененията включват:
- неправилна епителна стратификация (разслояване);
- загуба на полярност при базалните (намиращи се в основата) клетки;
- увеличен брой на митозите (вид клетъчно делене) и наличие на атипични митотични фигури;
- увеличен брой дискератотични клетки;
- клетъчна и ядрена атипия;
- увеличено съотношение ядро:цитоплазма;
- увеличен размер и брой на нуклеолите (ядърцата);
- хиперхроматизъм (по-интензивно оцветяване);
Класификацията от Любляна е ревизирана през 1971 година от Kambic и Lenart, които клинично и хистологично адаптират класификацията към специфичните изисквания за заболяванията на ларинкса.
Работна група на Европейската асоциация по патология ревизира и допълва хистологичните критерии на класификацията от Любляна на среща, проведена през ноември 1997 година в Лондон, Великобритания.
Класификацията от Любляна е разделена на четири категории, както следва:
- обикновена плоскоклетъчна хиперплазия — доброкачествена група:
- хиперпластичен епител;
- удебелен бодлив слой (stratum spinosum, стратум спинозум);
- непроменен базален-парабазален слой;
- нормално узряване;
- липса на клетъчен атипизъм;
- редки редовни митози в базалния слой;
- базална/парабазална клетъчна хиперплазия — доброкачествена група, при която има минимален риск от злокачествени изменения:
- увеличаване на базалните и парабазалните клетки — най-често в долните слоеве на епитела;
- непроменени клетки в бодливия слой;
- стратификация — плавно преминаване от базални клетки, разположени перпендикулярно на базалната мембрана към спинозни (от стратум спинозум) клетки, ориентирани хоризонтално на базалната мембрана;
- парабазални клетки — леко увеличена цитоплазма в сравнение с базалните клетки. Липсват междуклетъчни мостчета;
- базални клетки — леко уголемени ядра и равномерно разпределен хроматин;
- рядко се наблюдават митози в или близо до базалния слой;
- дискератотичните клетки са по-малко то 5%;
- атипична хиперплазия (рисков епител), която евентуално може да се трансформира до злокачествено заболяване:
- все още е налице стратификация;
- увеличен брой на изменените епителни клетки, които най-често са ориентирани перпендикулярно на базалната мембрана;
- повишено съотношение ядро: цитоплазма;
- променени епителни клетки в долната половина на епитела и постепенно заемащи цялата епителна дебелина;
- увеличен брой митози, основно в долните две трети на епитела;
- дискератотични и апоптотични клетки, разположени най-често в целия епител;
Налице са два подвида на този вид изменения:
— базалноклетъчен тип, при който:
- няма междуклетъчни мостчета;
- липсва цитоплазмена еозинофилия (няма натрупване на еозин — цитоплазмата не се багри в розово);
- има клетки, ориентирани перпендикулярно на основната мембрана;
— спинозноклетъчен тип — липсват междуклетъчни контакти и е налице повишена цитоплазмена еозинофилия;
- карцином in situ — белези на злокачественост:
- загуба на стратификация или матурация на епитела;
- при епителните клетки е налице напреднала клетъчна или ядрена атипия;
- митозите са атипични, като са увеличени в целия епител;
- често се наблюдават дискератотични и апоптотични (апоптоза — програмирана клетъчна смърт) клетки;
Налице са два подвида:
— базалноклетъчен тип с наличие на междуклетъчни връзки, липса на цитоплазмена еозинофилия;
— спинозноклетъчен тип без междуклетъчни мостчета и с повишена цитоплазмена еозинофилия;
Обикновената и анормалната хиперплазия се считат за доброкачествени заболявания с 0.7% и 1% съответно риск за злокачествена трансформация.
Атипичната хиперплазия е преканцерозна лезия, като около 9.5% от случаите са с вероятност за злокачествено изменение.
Общите принципи на тази класификация, валидни за всички нейни категории, са:
- епителът обикновено е удебелен, въпреки че в малка част от случаите може да са налице области с намалена дебелина;
- базалната мембрана обикновено е запазена във всички категории, без категорични доказателства дори за минимална инвазия;
Наличието на повърхностен кератинов слой, който често присъства при всички степени на сквамозните интраепителни лезии, не е от значение при тази класификация.
От практическа гледна точка, класификацията от Любляна е създадена въз основа само на патохистологичните критерии при обикновената светлинна микроскопия, тъй като няма сигурни доказателства, че други техники за диагностика превъзхождат светлинната микроскопия.
Несъответствията между системата на СЗО и класификацията от Любляна започват с дефиницията в първата, че всяка категория в системата за дисплазия се счита за предшественик или потенциално злокачествена лезия, включително и леката дисплазия, която хистологично много прилича на базалната и парабазапната клетъчна хиперплазия, която пък е първата категория при класификацията от Любляна.
От друга страна, базалната и парабазалната клетъчна хиперплазия в класификацията от Любляна се счита за доброкачествена лезия, при която е налице минимален риск от злокачествена трансформация.
Хистологично обаче се наблюдават и някои прилики между двете класификации.
Атипичната хиперплазия при класификацията от Любляна е подобна на умерената дисплазия, но също така има и някои характеристики на тежката дисплазия.
Карциномите in situ и при двете класификации са с еднакви характеристики и особености. Въпреки това, някои случаи на тежка дисплазия попадат в категорията CIS в словенската класификация.
Някои проучвания посочват, че случаите с атипична и тежка дисплазия представляват най-опасната група, свързана с най-висок риск за развитие на карцином — между 19% и 28%.
Ларингеалните предракови лезии нямат специфичен външен вид и се възприемат по различен начин, като например:
- хроничен ларингит;
- кератоза;
- левкоплакия, представляваща бяло петно;
- еритроплакия — червено петно;
- хиперпластично-диспластични ларингеални лезии — налице е увеличение на епителните слоеве на ларинкса, като това може да е свързано с лека, умерена или тежка дисплазия;
Морфологията на повърхностните слоеве и образуването на кератинови пластове няма особено значение, нито пък някаква значима връзка с техния злокачествен потенциал.
Хистопатологичната диагноза информира клиницистите как да лекуват пациентите с доброкачествени, потенциално злокачествени или вече развили се злокачествени лезии.
Точната и единна терминология на плоскоклетъчните интраепителни лезии е от съществено значение за успешното сътрудничество между патолози, както и за правилната комуникация с клиницисти.
Терминологията при тези лезии, използвана в клиничните и патологичните доклади, се е променила значително през последните шест десетилетия. Постигнато е съгласие обаче за употребата на термини, които се използват само за клиничните прояви, но нямат никакво хистопатологично и прогностично значение.
Клинична картина
Най-често прилаганите клинични диагнози са ларингеална левкоплакия, еритроплакия и хроничен ларингит, които засягат основно истинските гласни гънки и по-рядко и други части на ларинкса, например епиглотис. Кератозата остава спорен термин, тъй като често се прилага грешно като взаимозаменяем термин при макроскопското и микроскопското описание на промените. Въпреки това, кератозата е конкретен хистологичен термин, използван, за да се означи появата на кератинов слой върху повърхността на плоския епител.
Лезиите могат да бъдат или рязко ограничени и да растат екзофитно (растеж на тумора навън от органа или тъканта), или да бъдат предимно плоски и дифузни (разпръснати). Повърхността им е грапава, може да бъде кафява до червена (еритроплакия) на цвят, евентуално с по-добре изразена васкуларизация (по-добре изразени кръвоносни съдове) или да са покрити с дифузни, но добре ограничени белезникави плаки.
Може да се наблюдава ограничено белезникаво удебеляване на лигавицата, покрита с екзофитно растящи брадавицовидни плаки с неправилна форма.
Може да се наблюдават и лезии във вид на петна, което се дължи на неравномерната дебелина на кератиновия слой.
Някои левкоплакични лезии са разязвени (6.5%) или комбинирани с еритроплакия (15%). За левкоплакичните лезии се смята, че имат нисък риск от злокачествена трансформация. Смесените бяло-червени лезии, означавани още и като пъстра левкоплакия или еритролевкоплакия, имат умерен риск за развитие, а най-голям риск за развитие на злокачествено заболяване има при чистата еритроплакия (лезиите с червен цвят).
Симптомите зависят от местоположението и тежестта на заболяването и обикновено повечето пациенти с прекурсорни лезии имат симптоми от няколко месеца или по-дълъг период от време, но може да бъдат и безсимптомни. Симптомите на заболяването включват:
- дрезгав глас;
- дразнене в гърлото;
- възпаление на гърлото;
- болки в гърлото;
- хронична кашлица;
Премалигнените лезии могат да бъдат или рязко ограничени и с екзофитен растеж, или да бъдат предимно плоски и дифузни, свързани отчасти с моментното количество на кератина.
Диагноза
Външният вид на премалигнените ларингеални лезии не може да подскаже за тяхната хистологична природа. Чрез ларингеална видеостробоскопия (специален метод, използван за визуализиране на вибраторната активност на истинските гласни гънки чрез използването на бързо повтарящи се светлинни импулси) също не може точно да се разграничат премалигнени от злокачествени заболявания.
Биопсията е златен стандарт за диагностика, поради което правилното вземане на проби е от изключително значение, тъй като неправилната биопсия ще доведе до грешни резултати.
Разработени са допълнителни техники, които помагат на клинициста да охарактеризира тези лезии и да извърши правилно биопсиите.
Към тези техники спада суправиталното оцветяване с толуидиново синьо и метиленово синьо, като оцветяването с толуидиново синьо се характеризира с 91% чувствителност, но само 52% специфичност.
Контактна ендоскопия, комбинирана с оцветяване с метиленово синьо, осигурява хистологична информация и дава възможност за оценка на кръвоносните съдове. Въпреки това, подповърхностната визуализация е ограничена до 150 микрона, което е недостатъчно за охарактеризиране на по-дебели лезии. Широкото използване на тази техника е ограничено, поради необходимостта от специално оборудване и богат професионален опит при интерпретирането на резултатите.
Човешката тъкан съдържа множество вещества, които флуоресцират, когато са изложени на синя светлина — автофлуоресценция. Различният начин на флуоресциране на увредените тъкани е било използвано за подпомагане диагностиката при злокачествените заболявания на ларинкса.
Ограниченията при тази техника са фалшиво положителни и фалшиво отрицателни резултати при изследване на белези, хиперкератозни лезии и възпаление.
Предизвиканата автофлуоресценция чрез прилагането на 5-аминолевулинова киселина (5-ALA) също има диагностична стойност. 5-ALA предизвиква избирателно натрупване на протопорфирин IX в туморите и последваща флуоресценция. Протопорфирин IX флуоресценцията се проявява в червено при използването на светлина с определена дължина на вълната.
Чувствителността на предизвиканата автофлуоресценция е 97%, а специфичността — 64%, което позволява разграничаването на хиперплазия или лека дисплазия от умерена дисплазия, тежка дисплазия, карцином in situ и инвазивен карцином.
Недостатък на метода е, че показва фалшиво положителни резултати при възпалени лезии.
С настоящите неинвазивни диагностични методи не може надеждно да се разграничат премалигнените лезии от инвазивен плоскоклетъчен карцином.
Използването на оптични и микроскопски техники е ограничено от невъзможността при тях да се визуализират първите няколко слоя от епителни клетки, за да се оцени субмукозната (подлигавичната) архитектура.
Използването на инфрачервена светлина увеличава тъканната пропускливост и може да предостави диагностична информация за тъканите, разположени под повърхността.
Оптичната кохерентна томография (ОСТ) е нов диагностичен метод, използван за изследване на епителната и подепителната архитектура. При този метод се използва светлина, която има дължина на вълната, близка до тази на инфрачервената светлина, и се използва за ин виво (in vivo) визуализация на напречното сечение на тъканите, с резолюция, която е близка до тази, използвана при хистологично изследване.
Досега не са били установени маркери, които да са надежден прогностичен фактор за злокачественото прогресиране на плоскоклетъчните интраепителни лезии. Най-добре е проучена ролята на протеините, участващи в клетъчния цикъл, като например p16, p21, p27, p53, циклин D1 и Е, но въпреки това нито един от тези маркери няма надеждна прогностична стойност. Откриването на пролиферативна активност, основно чрез имунохистохимично маркиране на пролифериращите (делящите се) клетъчни ядра и Ki67 (маркер за пролиферация Ki-67, marker of proliferation Ki-67) антигени, може да се използва само като помощен метод към светлинната микроскопия с цел по-обективно и надеждно стадиране на SIL.
Лечение
Лечението на премалигнените лезии има за цел пълното им премахване, но и едновременното запазване на качеството и ларинксната функция.
Точната диагноза е от решаващо значение за правилното вземане на решение.
Макроскопският вид на лезията се смята за най-важният фактор при определяне на лечението. Решението за това, каква терапия да се проведе, зависи главно от това дали са налице единични или множествени лезии или са налице плътно изглеждащи образувания на широка основа:
- единичните и множествените огнища трябва да бъдат напълно ексцизирани (цялостно премахнати) до всички видими ръбове, ако е възможно;
- в присъствието на разположена нашироко, плътна левкоплакия, трябва да се направи хистологично картографиране на лезията чрез множество биопсии, последвана от поетапна резекция (премахване на лезията на части), ако е възможно;
Други фактори, които могат да бъдат важни при вземането на решение за подходящо лечение, включват:
- общото състояние на пациента и състояние, позволяващо операция;
- физиологична възраст;
- коморбидност (едновременното присъствие на едно или повече заболявания като допълнение към основното заболяване);
- наличието на други рискови фактори;
Пациентът трябва да бъде информиран за потенциалните рискове от пресипналост и постоперативните (след операцията) промени в качеството на гласа, както и опасността за евентуален рецидив. Много е трудно да се предскаже точно кои лезии ще прогресират до злокачествени заболявания въз основа само на клиничната картина. Различни изследвания са показали, че клиничната картина показва много малко съответствие с основната патология.
Това, което прави вземането на решение трудно е, че обикновената хиперплазия, дисплазия и/или карцином могат да съществуват едновременно в една и съща лезия.
Основните характеристики, които се срещат при едно злокачествено заболяване, са:
- язва;
- еритроплазия (еритроплакия);
- гранули по повърхността;
- увеличено количество кератин (верукозен (като брадавица) външен вид);
- увеличаване на размера;
- рецидивиране след ексцизионни биопсии;
- продължително протичане;
Първоначалното лечение на дадена лезия трябва да започне с определяне дали тази лезия е нискорискова или е с висок риск, като за база служат анамнезата и клиничния преглед. Високорисковите лезии са тези, при които:
- е налице тежка дисплазия или карцином in situ според класификацията на Световната здравна организация (СЗО) или атипична хиперплазия или карцином ин ситу според класификацията от Любляна;
- са налице пациенти с лека до умерена дисплазия, при които се наблюдават един или повече от следните фактори:
- тютюнопушене;
- постоянен дрезгав глас;
- видима по време на ендоскопия лезия;
След въвеждането на ендоларингеалната (вътрегръклянната) микрохирургия са описани няколко основни микрохирургични техники, използвани за отстраняване на лезиите, засягащи ларинкса.
Тези техники включват:
- конвенционална инцизия (разрез, разрязване) или дисекция;
- бимануална ретракция (придърпване) и изрязване;
- ендоскопска операция;
- СО2 лазер;
Хиперпластичните и диспластичните лезии се ексцезират с микроларингоскопски техники, като целта е премахване на видимите лезии, а след това се налага внимателно проследяване поради риск от рецидивиране и възможна злокачествена трансформация.
При подозрителни лезии се изисква премахването на цялата лезия и тяхното хистологично изследване, за да се изключи инвазивен плоскоклетъчен карцином.
Случаите с обикновена или базална/парабазална клетъчна хиперплазия не се нуждаят от допълнително лечение след ексцизионна биопсия.
Карциномите in situ могат да бъдат лекувани хирургично или с лъчетерапия (радиотерапия).
Хирургичното лечение включва микроларингоскопия с ексцизия и хордектомия (пълното хирургично премахване на гласна връзка), като при микроларингоскопската ексцизия трябва да се отстрани цялата лезия, но да се запази подлежащата lamina propria (ламина проприя).
Използването на СО2 лазер е успешен метод за осъществяване на прецизна ексцизия, въпреки че е възможно термичното увреждане на подлежащата ламина проприя.
Според много автори приложението на СО2 лазер разполага със значителни предимства пред традиционните техники, включително:
- по-лесна за извършване процедура с липсата на кървене;
- по-слабо изразен оток;
- пълно възстановяване на гласа;
Многократното използване на лазерно лечение обаче може да доведе до образуване на белези, подобно на тези при стрипинг (Stripping), а резултатите в някои случаи могат да бъдат по-лоши, отколкото при обикновена ексцизия, особено след повторни процедури.
Средство на избор за хирургичното отстраняване на атипична хиперплазия и/или карцином in situ е стрипинг на гласните струни, последван от внимателно проследяване до края на живота. Стрипингът представлява премахване на лигавицата на гласните гънки, включително и лезията от вокалния израстък (processus vocalis на пирамидния хрущял — cartilago arytenoidea) до предната комисура (comissura anterior).
Налице е обаче значителен риск от получаване на белези, поради което този метод е заменен от по-прецизната микрохирургична ексцизия.
Хирургичната терапия осигурява материал за патологичен анализ и може да се повтаря толкова често, колкото е необходимо. Качеството на гласа е запазено в повечето случаи.
Честотата на рецидивите при CIS, лекувани чрез операция, е по-голяма от тази при пациенти, при които е използвана лъчетерапия и е около 20% след първоначалната ексцизия.
Хирургичното лечение се предпочита при фокални (огнищни) лезии на пациенти, които са отговорни към състоянието си и няма да пропускат рутинните прегледи.
Лъчевата терапия също е ефективно лечение за карциноми in situ и трябва да се използва само в случаите, при които се наблюдава CIS. Този вид лечение е особено полезен при:
- множество рецидиви след хирургична ексцизия;
- рецидивиране на карциноми in situ след стрипинг на гласните струни или когато стрипинг не е възможен;
- дифузни лезии, простиращи се извън гласните струни и които не могат да се ексцизират без значителни последствия;
- пациенти, които не могат да бъдат проследявани по някаква причина;
- пациенти в тежко общо състояние, които са неподходящи за обща анестезия.
Качеството на гласа е добре запазено след радиотерапия.
Основният недостатък на лъчетерапията е, че не може да се повтори, ако е налице рецидив или втори тумор в областта на облъчване.
Лечението на рецидивиращи премалигнени лезии зависи основно от тяхната хистология:
- повтарящата се фокална (огнищна) лека или умерена дисплазия трябва да се ексцизира, ако е възможно;
- рецидивиращата и разпространяваща се лека или умерена дисплазия може да бъде наблюдавана или ексцизирана, като ексцизията е особено приложима, ако се наблюдава изменение във външния вид (еритроплазия) и структурата (хетерогенни, пролиферативни характеристики);
- повтарящите се фокални лезии, при които се наблюдава тежка дисплазия трябва да бъдат третирани като Т1 ларингеален карцином, с прилагане на резекция, където е възможно;
- персистираща (постоянно присъстваща) или рецидивираща тежка дисплазия — лъчетерапията трябва да се разглежда като вариант за лечение особено при пациенти, които продължават да пушат;
Лъчетерапията може да бъде обсъдена от мултидисциплинарен екип при определени обстоятелства, включващи:
- пациенти, които са имали два или повече рецидиви;
- пациенти, които продължават да пушат;
- пациенти, които имат по-висок риск за усложнения от анестетици;
- пациенти, при които има проблем с оперативния достъп;
- предпочитанията на пациента;
Използването на фармакологични или физически агенти може да намали вероятността за злокачествена трансформация при лица с висок риск за развитие на инвазивно заболяване.
Комбинацията от 13-цис ретинолова киселина, интерферон алфа и алфа-токоферол е ефективна срещу умерена и тежка дисплазия и за предотвратяване на по-нататъшни лезии.
Едномесечно прилагане на консервативни мерки е разумно при отсъствието на всякакви симптоми, показващи влошаване на гласовите характеристики, разширяваща се лезия или при клинични признаци на инвазивен карцином. Консервативните мерки включват:
- обучение на пациента за правилната хидратация (оводняване на организма);
- намаляване употребата на кофеин и алкохол;
- избягване въздействието на професионални рискови фактори, ако е възможно;
- избягване на витаминен дефицит;
- лечение на вирусните (т.е. HPV) инфекции;
- елиминиране на всички останали дразнители на гърлото, особено спиране на пушенето.
Симптоматичните пациенти с ларингофарингеален рефлукс също трябва да бъдат консултирани за потенциалните рискове и да им бъде предложено антирефлуксно лечение.
Ето защо пациентът се нуждае от подходящо консултиране по отношение на тези рискови фактори като част от цялостния план за лечение.
Химиопрофилактиката с ретиноиди, селен и други агенти все още е спорна.
Основен недостатък при използването на ретиноиди е, че заболяванията имат склонност за рецидивиране, когато лечението се преустанови. Също така има значителни странични ефекти, дължащи се кожно-лигавична токсичност.
Амбулаторното лечение на злокачествените изменения на ларинкса включва премахването на премалигнени лезии чрез фотодинамична терапия (PDT) и лазерни системи — например пулсиращ багрилен лазер (PDL) и пулсиращ KTP (калиево-титаниев фосфат — KTiOPO4) лазер.
PDL и KTP лазерите са двата най-широко използвани лазери за амбулаторно лечение на ларингеалните епителни лезии, включително левкоплакия, кератоза и дисплазия, като при около 80% от пациентите се наблюдава значителна регресия (обратно развитие) на заболяването.
Освен известните предимства на амбулаторното лечение (избягване на обща анестезия, по-ниска цена, по-добра ефективност), използването на тези лазерни системи има минимален ефект върху околната тъкан, а образуването на белези е необичайно.
Едновременното двустранно лечение на лезии в и около предната комисура е възможно, като е налице минимален риск за възникване на усложнения.
Един от основните недостатъци на амбулаторните процедури при лечението на ларингеални лезии, особено при дисплазия, е липсата на биопсичен материал за патологично изследване, поради което не е възможна окончателна оценка на туморното развитие и резекционните ръбове.
Биопсичен материал може да бъде взет в операционната зала или в амбулаторията чрез ендоскопия.
Фотодинамичната терапия използва нетоксични химични вещества, които се натрупват в диспластичните или злокачествените клетки. Този тип лечение е подробно разгледан при:
Прогноза
Тъй като някои лезии показват лека дисплазия, а дори и тези без дисплазия крият риск от прогресия до инвазивен рак, дългосрочното проследяване на всички премалигнени ларингеални лезии е наложително. Злокачествената трансформация е многоетапен процес, който отнема много години — в някои случаи повече от 10 години след първоначална биопсия.
Всички пациенти трябва да бъдат проследявани внимателно чрез:
- използване на гъвкав назален ендоскоп или разработеният от Харолд Хопкинс през 1956 година ригиден (твърд) ендоскоп със студена светлина, за да се визуализира ларинкса;
- цветна фотодокументация;
- ако е възможно, може да се направи стробоскопия, но всъщност не е от съществено значение;
Високорисковите пациенти трябва да се проследяват по същия начин, както е при Т1 ларингеален карцином:
- всеки месец през първата година;
- през два месеца по време на втората година;
- през три месеца третата година;
- през шест месеца за 4 и 5 година;
Нискорисковите пациенти, при които е налице лека или умерена дисплазия, без да са налице видими лезии или дрезгавост, или не са пушачи, трябва да бъдат проследявани през 6 месеца. Препоръчва се проследяване в рамките най-малко на 2 години.
Прилагането на лъчетерапия с цел предотвратяване прогресията на диспластични лезии до карцином не е подходящо, като в действителност може дори да ускори злокачествената дегенерация. Ако са налице мултицентрични карциноми (повече от един в една лезия) в хиперпластичните лезии, случайни биопсии не се препоръчват.
Извършва се ексцизионната биопсия, като се обръща специално внимание върху запазването на структурната цялост на по-дълбоко разположените незасегнати слоеве на гласните връзки и на заобикалящата нормална лигавица.
Библиография
https://consultqd.clevelandclinic.org/contemporary-management-of-laryngeal-dysplasia-starts-with-high-tech-imaging/
Коментари към Карцином in situ на ларинкс МКБ D02.0