Карцином in situ на стомах МКБ D00.2
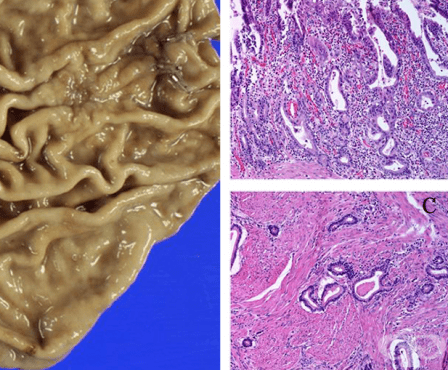
В това МКБ D00.2 Карцином in situ на стомах се разглеждат предраковите изменения на един от основните органи в стомашно-чревния тракт — стомах. Към тези преканцерозни (предракови) заболявания спадат:
- атрофичен гастрит
- интестиналната метаплазия
- стомашната интраепителна дисплазия/неоплази
- аденоми на стомаха (надигната интраепителна неоплазия)/стомашните полипи.
Стомахът — gaster (ventriculus), представлява торбесто разширение на храносмилателния канал, в което храната се натрупва, подлага се на въздействието на стомашен сок и се насочва във вид на каша в посока тънкото черво.
Лигавицата на стомаха — tunica mucosa, се характеризира с различно изразени нагъвания в зависимост от степента на разтягане на стомаха.
По цялото си протежение стомашната лигавица е "тапицирана" с еднореден цилиндричен епител, като образувания на лигавичния епител са стомашните жлези, разположени в lamina propria, която е изградена от финовлакнести съединителнотъканни влакна, дифузно инфилтрирани с лимфоцити.
Мускулната пластина на лигавицата — lamina muscularis mucosae, е съставен от циркулярни и надлъжни мускулни влакна.
Подробно описание на анатомичните особености на стомаха ще намерите в:
Анатомия на стомах (gaster, ventriculus)
Стомашният карцином представлява злокачествен епителен тумор на стомашната лигавица с жлезна диференциация. Етиологията (причината за развитие) му е многофакторна, като най-често се развива след дълго развиващ се атрофичен гастрит.
Епидемиология
Ракът на стомаха е четвъртият най-често диагностициран рак и втората най-честа причина за смърт, свързана с раково заболяване.
Около 870 000 нови случаи на рак на стомаха се диагностицират всяка година в световен мащаб. Налице са значителни географски вариации в честотата на този вид рак. Различни данни показват, че областите с най-висок процент на заболеваемост (> 40/100 000) са в Източна Азия, региона на Андите в Южна Америка и Източна Европа. Ниска честота (< 15/100 000) се среща в Северна Америка, Северна Европа, както и в повечето страни в Африка и Югоизточна Азия.
Стомашният карцином се среща изключително рядко под 30-годишна възраст, след което честотата му се увеличава бързо и непрекъснато, за да достигне най-високи нива в крайните възрастови групи — както при мъже, така и при жени.
Етиология
Съществуват различни етиологични фактори за развитието на стомашен карцином:
- режим на хранене — с най-голямо значение при чревния тип карциноми. Редовният прием на пресни плодове и зеленчуци намалява рисковете за развитие на рак, поради своите антиоксидантни ефекти. Аскорбиновата киселина, каротеноиди, фолати и токофероли се считат за активни съставки. Приемът на сол е свързан с висок риск за развитие на карцином на стомаха и неговите прекурсорни лезии. Други храни, свързани с висок риск при някои популации, включват пушени и сушени меса или риба, мариновани зеленчуци и люти чушки;
- жлъчен рефлукс — рискът от стомашен карцином се увеличава 5-10 години след стомашна операция, особено след операция по Билрот (Bilroth) II;
- инфекция с Helicobacter pylori;
Подробна информация за карцинома на стомаха може да прочетете при:
Злокачествено новообразувание на стомаха мкб C16
Първият вид потенциално злокачествени изменения на стомаха са:
Аденоми на стомаха/стомашни полипи:
Стомашните епителни неопластични лезии, които не отговарят на критериите за аденокарцином, се означават като аденоми, когато те са надигнати, нодуларни (възловидни) или откровено полиповидни и като дисплазия (анормално развитие или растеж на тъкани, органи или клетки), когато те са плоски.
Аденомите (надигната интраепителна неоплазия според новата класификация на Световната здравна организация) са окръглени, доброкачествени лезии, съставени от тубуларни и/или вилозни структури, показващи интраепителна неоплазия. Честотата на злокачествената трансформация зависи от размера и хистологичните (тъканните) изменения. Развива се при около 2% от лезиите, които са < 2 см и в 40-50% от лезиите > 2 см. Плоските аденоми имат по-голяма склонност да прогресират до рак.
За разлика от дебелото черво, аденомите на стомаха не са основния прекурсор за аденокарциноми, като повечето стомашни аденокарциноми не са свързани с наличието на предшестващ аденом. Въпреки това, стомашни аденоми са пряк предшественик на някои стомашни карциноми и служат като маркери, показващи повишен риск за развитие на аденокарцином в други области на стомаха.
Те се развиват в области на стомаха, където нормалната тъкан е изменена поради хронично възпаление.
Ако не се лекува, стомашният аденом може да се трансформира в аденокарцином — най-често срещания стомашен тип рак. Аденомите на стомаха се развиват най-често в антрума на стомаха, размерът им обикновено е 3-4 см и е по-вероятно да се превърнат в рак, ако:
- са по-големи от 2 см;
- са високостепенни;
- имат малки, подобни на пръстчета израстъци (вилозен аденом);
Рискови фактори
Рисковите фактори, които могат да повишат вероятността за развитие на стомашен аденом, са:
- фамилна аденоматозна полипоза (FAP) — наследствено заболяване, което води до развитието на стотици до хиляди полипи по лигавицата още в юношеството;
- хроничен атрофичен гастрит — лигавицата на стомаха изтънява (атрофия), което се дължи на продължително стомашно възпаление (гастрит);
Симптоми
Малките стомашни аденоми не причиняват никакви симптоми. Симптоматика се развива, ако стомашния аденом нарасне, което води до обструкция (запушване) в стомаха.
Диагноза
Диагнозата се поставя с помощта на:
- физикален преглед;
- ултразвуково изследване;
- гастроинтестинална (стомашно-чревна) ендоскопия;
- ендоскопска биопсия;
Лечение
Лечението на стомашните аденоми може да включва:
- ендоскопско премахване на полипите;
- гастростомия — оперативно създаване на отвор на стомаха,;
- парциална гастректомия — премахване на част от стомаха;
Стомашните полипи биват няколко вида:
- хиперпластични полипи — това са едни от най-често срещаните полипи. Те са неподвижни или на краче, обикновено < 2.0 см в диаметър и обикновено възникват в антрума, където се наблюдава гастрит, предизвикан от H. pylori. Повърхността им често ерозира. В малка част от случаите карцином се развива в рамките на полипа, в области с чревна метаплазия и дисплазия;
- полипи по фундусните (в областта на стомашното дъно) жлези — най-често срещаните стомашни полипи в западните популации. При пациенти с FAP може да се развие дисплазия и карцином в тези полипи;
- полипозни синдроми — полипи на Peutz-Jeghers (Пойтц-Йегерс), ювенилни (развиват се в юношеска възраст) полипи и полипи на Cowden. При тези синдроми стомашен карцином се развива рядко;
Атрофичен гастрит, интестинална (чревен тип) метаплазия и стомашна епителна неоплазия/дисплазия
Това са най-често срещаните предракови заболявания на стомаха и са свързани с повишен риск за развитие на стомашен карцином.
Тъй като липсват единни насоки, налице са големи различия в лечението на пациенти с тези премалигнени (предракови) състояния. Поради тази причина Европейската асоциация по гастроинтестинална ендоскопия (ESGE), Европейската група за изследване на Helicobacter pylori (EHSG), Европейската асоциация по патология (ESP) и Португалското дружество по гастроинтестинална ендоскопия (SPED) са комбинирали усилия, за да създадат общи указания за терапия на пациенти с предракови състояния и заболявания на стомаха (MAPS).
Мултидисциплинарен екип от 63 експерти от 24 страни са разработили тези препоръки чрез онлайн гласуване и последваща среща в Порто, Португалия.
Препоръките наблягат върху увеличения риск за развитие на рак при пациенти със стомашна атрофия и метаплазия, както и необходимостта от адекватно стадиране при случаите на високостепенна дисплазия и се фокусират върху указанията и методите за лечение и наблюдение.
Интестиналният (чревен) вид стомашен рак се развива чрез каскада от добре дефинирани и разпознаваеми прекурсори и представлява крайния етап в последователността възпаление-метаплазия-дисплазия-карцином, известна като каскада на Кореа (Correa) за многоетапната стомашна канцерогенеза (развитието на рак), където може да настъпи прогресия от нормална лигавица през хроничен неатрофичен гастрит, атрофичен гастрит и интестинална метаплазия до дисплазия и карцином. Този модел е потвърден в различни проучвания.
Идентифицирането и наблюдението на пациентите с такива прекурсорни лезии може да доведе до ранна диагностика на стомашния рак. Въпреки че тези лезии са често срещани в ежедневната практика, няма международни препоръки, които да насочват клиницистите в грижите им за лица с тези промени. Това води до значителна хетерогенност на случаите и до неуспех в диагностицирането на пациенти с лечими форми на рак.
Този проект цели да обобщи досегашните доказателства за лечението на пациенти с предракови състояния и заболявания, както и да предложи насоки за диагностика и лечение на пациенти с хроничен гастрит, лигавична атрофия, интестинална метаплазия и дисплазия.
Тези насоки не се отнасят до методиките за скрининг на тези лезии в общата популация или оценяването на лечението на пациентите с други предракови състояния, като например пернициозна анемия, болест на Menetrier или лечението на стомашен аденокарцином.
Тези препоръки са разработени в съответствие с процедурата, описана от програмата за Експертна оценка на насоките за научни изследвания и оценяване — Appraisal of Guidelines for Research and Evaluation (AGREE).
През май 2010 се събира група от европейски гастроентеролози и патолози, включително клинични специалисти и млади изследователи, подготвени в медицината, основана на доказателства.
Тази група се среща през октомври 2010 година в Барселона и постига съгласие относно методологията, която трябва да се приложи, както и за набор от ключови въпроси и предварителни данни, които да насочат към търсенето на точната информация.
Групата работи в подгрупи, за да може да осъществи системно търсене на доказателства, да преразгледа данни, получени въз основа на качествени доказателства и да издаде становища и препоръки.
Препоръчаните насоки са гласувани в две онлайн сесии и последвани от втора среща в Португалия.
Като резултат от съвместната работа са създадени различни препоръки, които ще бъдат посочени по-долу:
- конвенционалната ендоскопия с бяла светлина не може точно да отдиференцира и диагностицира преканцерозните (предраковите) състояния/лезии на стомаха, поради което може да се приложи увеличителна хромоендоскопия (техника, при която се прилага оцветяване по време на ендоскопия, за да се подчертаят различията и злокачествените промени на лигавицата, които не могат да се видят при конвенционална ендоскопия) или теснолентов светлинен режим (Narrow Band Imaging — NBI — ендоскопска техника, при която се използва определена дължина на вълната на синята и зелената светлина, за да се видят по-добре някои детайли от лигавичната повърхност) с или без увеличение, за да се подобри диагностиката на такива лезии;
- най-малко четири биопсии на проксималната (близката) и дисталната (далечната) част на стомаха, на малката и голямата му кривина, са необходими за адекватна оценка на премалигнените (предраковите) стомашни заболявания;
- системи за хистопатологично стадиране (например оперативно звено за оценка на гастрит [OLGA] и оперативно звено за оценка на интестиналната (чревната) метаплазия на стомаха [OLGIM]) могат да бъдат полезни при идентифицирането на подгрупи от пациенти с различни рискове за развитие на рак на стомаха, а именно тези с обширни лезии (т.е. атрофия и/или чревна метаплазия в антрума и тялото);
- пациентите със значителна атрофия и/или обширна чревна метаплазия трябва да се подложат на ендоскопско наблюдение на всеки 3 години;
- пациентите, които са с лека до умерена атрофия/чревна метаплазия само в антрума, не се нуждаят от проследяване;
- ако е налице инфекция с Helicobacter pylori, тя трябва да бъде излекувана, за да се предотврати развитието на високостепенна дисплазия или карцином;
- за момента използването на инхибитори (потискащи действието) на циклооксигеназа-2 (COX-2) или приложението на хранителни добавки с антиоксиданти (аскорбинова киселина и бета-каротин) не са били одобрени като средства за намаляване на риска от прогресия на стомашните преканцерозни лезии;
- пациенти с дисплазия, но без ендоскопски видима лигавица, трябва да бъдат внимателно проследявани — или веднага и 6 до 12 месеца след това, или в рамките на 12 месеца, съответно за тези с високостепенна или нискостепенна дисплазия. Пациентите с дисплазия или рак в рамките на ендоскопски видими лезии трябва да бъдат подложени на стадиране и резекция (изрязване);
Когато се разглеждат проблеми, свързани с предраковите изменения, много е важно да определи какво точно се разбира под този термин, затова е добре да се направи разграничение между предраково състояние и предракова лезия.
Предраковото състояние е най-добре да се разглежда като клинично състояние, свързано със значително повишен риск от рак, докато преканцерозната лезия представлява хистопатологична аномалия, в която е много по-вероятно да се развие карцином, в сравнение с нормалната тъкан. При много клинични състояния, които са с повишен риск за развитие на карцином, също се наблюдават разграничими предракови лезии, но невинаги е така.
Като преканцерозни състояния се разглеждат лигавичната атрофия на стомаха и интестиналната метаплазия.
Хроничен атрофичен гастрит и интестинална метаплазия:
Хроничният атрофичен гастрит и интестиналната метаплазия обикновено предшестват и/или съпътстват чревния тип аденокарцином, при тях има по-висок риск за развитие на аденокарцином на стомаха (особено във високорисковите райони) и трябва бъдат лекувани адекватно, за да не се стигне до развитие на високостепенна дисплазия и инвазивен карцином, т.е. те се считат за предракови състояния.
Атрофията на стомашната лигавица и метаплазията от чревен тип представляват висок риск за развитието на стомашен рак, защото те представляват основата, от която се развиват дисплазия и интестинален тип стомашен аденокарцином.
Свързаният с H. pylori гастрит е най-често срещаната прекурсорна лезия. Автоимунният гастрит също е свързан с повишен риск за развитие на карцином. Ако е налице гастрит, настъпва стомашна атрофия, последвана от чревна метаплазия, като започват и серия от промени, които могат да доведат до неоплазия, особено от рак от чревен тип.
Противоположно на това, дифузният тип рак на стомаха често възниква в стомах, при който липсва атрофичен гастрит с интестинална метаплзия.
Хроничният атрофичен гастрит трябва да бъде диагностициран и стадиран въз основа на наличието на хронично изменени възпалителни клетки, включително лимфоцити и плазматични клетки, които се разпростират до lamina propria (ламина проприя), но липсват в нормалните жлези. В тялото/фундуса на стомаха това е свързано със загуба на специализирани клетки и с последващо намаляване на стомашните секреторни функции.
Различните индивиди могат да развият различни фенотипове (видове) на хроничен гастрит, което се дължи на различните генетични характеристики при хората, както и на експозиция на факторите на околната среда:
- случаи с възпалителни изменения, ограничени до антрума и без жлезна атрофия и/или чревна метаплазия, се определят като дифузен антрален гастрит;
- случаите на жлезна атрофия и/или чревна метаплазия, разпределени мултифокално (засягащи няколко различни области наведнъж) и включващи малката кривина на стомаха, са определени като мултифокални атрофични гастрити;
Чревната метаплазия може да се класифицира като "пълна" или "непълна".
Пълната чревна метаплазия (тънкочревна или тип I) се характеризира с чашковидни и абсорбтивни клетки, намалена експресия (изява) на стомашни муцини (MUC1, MUC5AC и MUC6) и експресия на чревен муцин (MUC2).
Непълната интестинална метаплазия ("ентероколитна" или тип IIA/II, както и "колитна" или тип IIB/III) се характеризира с чашковидни и цилиндрични неабсорбтивни клетки и с коекспресия на стомашни муцини (MUC1, MUC5AC и MUC6) с MUC2.
Според класификацията на Filipe типизирането на интестиналната метаплазия (типове I, II и III) се основава на откриването на сиаломуцин и сулфомуцин чрез оцветяване с железен хелат на диамин и алцианово синьо (този подход е прекратен поради токсичността на реактивите).
В момента се използват класификации, които вземат под внимание:
- наличието на клетки на Панет, Paneth (пълна метаплазия);
- структурни промени под формата на полумесец
- дедиференциация (връщане към по-ниско диференцирани (развити) форми);
- определяне в каква степен липсват клетки на Панет (непълна метаплазия);
- определяне на модела и типа на муцинова експресия;
Някои проучвания показват положителна корелация (връзка) между степента на непълна чревна метаплазия и степента на пълната чревна метаплазия. Въпреки това, използването на имунохистохимия или други специални техники с цел типизирането на интестиналната метаплазия, не е широко разпространено в рутинната диагностика.
Наскоро е описан друг модел на метаплазия, означена като спазмолитична полипептид-експресираща метаплазия (SPEM). Тя се характеризира се с експресията на спазмолитичния полипептид TFF2, който е свързан с париетална атрофия. SPEM, който по принцип се развива в тялото и фундуса на стомаха, има някои общи характеристики с псевдопилорната метаплазия, свързан е с хроничната инфекция с Helicobacter pylori и със стомашния аденокарцином, а освен това е възможно да представлява друг път към стомашната неоплазия.
Последното предраково състояние, което се разглежда в МКБ D00.2 Карцином in situ на стомах, е:
Стомашна интраепителна неоплазия/дисплазия:
Стомашната интраепителна неоплазия/дисплазия се смята за предпоследния етап на стомашната канцерогенеза и се характеризира с променливо клинично протичане.
Терминът интраепителна дисплазия/неоплазия обаче е сложен и объркващ, тъй като няма единна класификация по отношение на характеристиките, които спомагат за разграничаване между дисплазия/неоплазия и ранен стомашен рак.
Освен това е трудно да се направи разграничение между стомашна епителна дисплазия/неоплазия и ранен стомашен рак с помощта на биопсии, което се дължи на неточностите при вземането на биопсичен материал от злокачествена ракова област. Това диагностично несъответствие често води до неподходящо лечение при стомашните интраепителни неоплазии.
В началото на 80-те години са разработени насоки за диагностика и стадиране на стомашната епителна неоплазия, като е предложена тристепенна класификация (лека, умерена и тежка дисплазия). Предлогът "дис" означава анормален/необичаен, а "плазия" означава растеж, следователно дисплазия е термин, използван за анормален растеж на епителните клетки.
Дисплазия обикновено се използва за недвусмислен неопластичен епител, който може да бъде свързан с развитието или самия той да се развие до инвазивен аденокарцином.
Лезиите, които повечето европейски и американски патолози идентифицират като дисплазия, често се считат за аденокарциноми в Япония, тъй като според японските специалисти стомашния карцином се диагностицира въз основа на ядрена и структурна атипия, дори когато отсъства инвазия, поради което докладите на японските и западните патолози много често показват големи различия.
Класификация
Тези несъответствия са довели до създаването на няколко класификации, насочени към точната терминология на не-неопластичните промени и ранния инвазивен карцином. През септември 1998 година около 30 патолози от 12 страни се срещат във Виена, точно преди Световния конгрес по гастроентерология, и постигат консенсус по отношение на терминологията за гастроинтестиналната епителна неоплазия — Виенска класификация.
В тази класификация, "високостепенната дисплазия/аденом", "неинвазивния карцином (карцином in situ)" и "съмнения за инвазивен карцином", са групирани в една и съща категория (категория 4), наречена "неинвазивна високостепенна неоплазия", за да се премахнат диагностичните различия между западни и японски патолози. Тъй като тези три диагнози не могат да бъдат добре отграничени и препоръките за лечение ще бъдат едни и същи за всяка диагноза, тези лезии се считат за премалигнени. В началото на 2000 година Виенската класификация е ревизирана и, поради същата причина, интрамукозния (развиващ се в лигавицата) карцином е добавен като четвърта подкатегория на категория 4, защото е трудно да се определи дали е налице инвазия в lamina propria и защото, от терапевтична гледна точка, разликата между всяка от четирите подкатегории е без значение.
След въвеждането на ревизираната Виенска класификация, съгласуването относно диагнозите се подобрява до 80% за стомашните лезии. Практическата трудност за диагностициране на стомашната епителна дисплазия си остава тълкуването на терминологията, използвана от патолозите, от лекуващите лекари.
Използването на термина дисплазия обърква клиницистите, защото ендоскопията и хирургичното лечение са свързани с правни и социални проблеми и повечето западни хирурзи няма да пристъпят към операция, ако патолозите не са ясно диагностицирали дисплазията като рак. Това е и причината понастоящем да не възможно да се елиминира диагнозата дисплазия в стомашната лигавица.
СЗО, позовавайки се на широкото използване на двата термина — "дисплазия" и "интраепителна неоплазия" (IEN), използва тези термини като синоними (в това МКБ се използва основно термина дисплазия).
Наново ревизираната класификация на Световната здравна организация за неоплазия в гастроинтестиналния тракт е публикувана през 2010 година и в нея терминът дисплазия е описан като "интраепителна неоплазия (дисплазия)", като думата "дисплазия" се поставя в скоби.
Класификацията на СЗО описва високостепенната интраепителна неоплазия в стомаха като лезия с "жлезни струпвания и ясно изразен клетъчна атипия". Тубулите (малки тръбоподобни структури, каналчета) могат да са с неправилна форма, със значителни разклонения и нагъвания, но без стромална (строма — опорна структура на даден орган) инвазия".
Секрецията на муцин (слуз) липсва или е ограничена до минимум, а в целия епител е налице повишена пролиферативна (пролиферация — разрастване на тъканите чрез размножаването на клетките с делене) активност.
Според класификацията на СЗО, инвазивен аденокарцином се диагностицира, когато туморът инвазира (навлезе) в lamina propria (ламина проприя) или субмукозния (подлигавичния) слой. Освен това, наличието на изолирани туморни клетки и жлезоподобни и/или папиларни (папили - малки издатини) структури при биопсично изследване, спомагат за разграничаването на стомашен аденокарцином от интраепителна неоплазия.
Дефиницията на СЗО за високостепенната интраепителна неоплазия се основава главно на описателните термини "разклоняване и нагъване" на жлезите. Тези два описателни термина оставят много място за субективна интерпретация. От друга стана, инфилтрацията на субмукозния слой от единични неопластични тубули не е описана като "жлезно разклоняване", а като чист карцином, дори без присъствието на единични туморни клетки.
Според настоящата класификация от Виена (Виенска класификация), интраепителната неоплазия/дисплазия се подразделя на следните подкатегории:
- отрицателен резултат за интраепителна неоплазия/дисплазия;
- интраепителна неоплазия/дисплазия с неопределена значимост — понякога, поради недобро вземане на биопсичен материал или вземане на малко количество, е трудно да се направи разлика дали лезията е неопластична или не-неопластична, реактивна или регенеративна. Диагнозата "дисплазия с неопределена значимост" не е строго дефинирана, а по-скоро временно понятие, което е необходимо, за да се продължи проследяването на пациента и да се направят повече биопсии, за да се стигне до окончателна диагноза;
- нискостепенна интраепителна неоплазия/дисплазия (LGIN) — тази лезия показва променена лигавична архитектура (структура), включително наличието на тубуларни структури с разширения и разклонения, нагънати папили, удължени крипти и кистозни промени;
- високостепенна неинвазивна неоплазия/дисплазия — налице са нарастващи структурни изменения с жлезно струпване и ясно изразен клетъчен атипизъм. Тубулите могат да бъдат с неправилна форма, с множество разклонения, разширения и вътрелуменални (в лумена, просвета) мостчета, но няма стромална инвазия. Плеоморфните (можещи да изменят формата и размера си) ядра се характеризират с видими амфифилни (проявяват едновременно хидрофилни и липофилни характеристики) нуклеоли (ядърца) и загуба на полярност. Повишена пролиферативна активност е налице в целия епител.
4.1 високостепенен аденом/дисплазия;
4.2 неинвазивен карцином (карцином in situ);
4.3 съмнения за инвазивен карцином;
4.4 интрамукозна инвазивна неоплазия/ интрамукозен карцином;
В стомаха, категория 1 включва хроничен атрофичен гастрит и чревна метаплазия. Когато има съмнение за това дали лезията е неопластична или не-неопластична (т.е. реактивна или регенеративна), особено при малки биопсични проби с преобладаващо възпаление, диагнозата трябва да бъде интраепителна неоплазия/дисплазия с неопределена значимост. В такива случаи дилемата обикновено се решава чрез разрези на по-дълбоки слоеве за получаване на допълнителен материал за биопсия или след преразглеждане на възможната етиология.
Интраепителната неоплазия/дисплазия включва ясно изразена епителна неопластична пролиферация, характеризираща се с променлив клетъчен и архитектурен атипизъм, но без убедителни доказателства за инвазия.
Нискостепенната интраепителна неоплазия/дисплазия показва минимални структурни нарушения и само лек до умерен цитологичен (клетъчен) атипизъм:
- ядрата са удължени, поляризирани и базално (в основата на клетката) разположени;
- митотичната (митоза — вид клетъчно делене) активност е леко до умерено изразена;
Високостепенната интраепителна неоплазия/дисплазия се характеризира с:
- неопластични клетки, които по-често са кубовидни, а не цилиндрични;
- увеличено съотношение ядро: цитоплазма;
- видими амфофилни нуклеоли;
- по-силно изразени структурни нарушения;
- множество митози;
Важно е да се отбележи, че ядрата често се разпростират до луменалната (вътрешната по-светла) част на клетката, а ядрената полярност обикновено се губи. Повечето пациенти, които имат изменения, класифицирани като високостепенна дисплазия, са изложени на висок риск за развитие или на синхронен (развитие на два или повече карциноми по едно и също време) инвазивен карцином, или за бързото развитие на карцином.
Лезии, определени като високостепенна интраепителна неоплазия, не се различават много от инвазивен карцином що се касае за молекулни и генетични промени. При ежедневната работа диагноза високостепенна интраепителна неоплазия се поставя много рядко, тъй като повечето от тези лезии са вече инвазивни карциноми.
Като интрамукозната инвазивна неоплазия/интрамукозен карцином се определят карциноми, които нахлуват в ламина проприя и се отличават от интраепителната неоплазия/дисплазия не само по десмопластичните промени (образуване на съединителна тъкан), които могат да бъдат минимални или да отсъстват, но също така и по отчетливите структурни аномалии, като:
- наличие на жлезно струпване;
- множество разклонения или разширения;
- сливащи се или крибриформени жлези;
Диагнозата интрамукозен карцином показва, че има повишен риск от лимфна инвазия и метастази в лимфни възли. Въпреки това, ендоскопските техники позволяват лечение, без да е необходима отворена операция, особено за лезии ≤ 2 см по размер, както и за тези, които са добре диференцирани и не показват лимфна инвазия.
Ранният рак на стомаха (EGC) представлява карцином, ограничен до лигавицата или до субмукозата, независимо от състоянието на лимфните структури. Ранният стомашен рак обикновено е малък, асимптомен и има добра прогноза, докато напредналия рак на стомаха се характеризира с по-висок процент на смътност. Ето защо ранното откриване на раково състояние е важно за подобряване на прогнозата, както и за ефективно лечение и намаляване на случаите на смърт при стомашен карцином.
Хистологично, повечето карциномни подтипове се развиват като ранен стомашен рак в чист вид или като смесени форми. Надигнатите карциноми с папиларен, грануларен или нодуларен (възлест) характер и червен цвят са най-често добре или умерено диференцирани и имат интестинални характеристики, а понякога може да се установи и аденом.
Плоските, слабо диференцирани карциноми могат да съдържат остатъчни или регенеративни мукозни (лигавични) островчета. Разязвените лезии са или интестинален, или дифузен тип рак.
Карцином се диагностицира, когато туморът инвазира в lamina propria (интрамукозен карцином) или в muscularis mucosae (един от подслоевете на лигавицата). Някои стомашни биопсии съдържат области, предполагащи истинска инвазия (например изолирани клетки, жлезоподобни структури или папиларни издатини).
Терминът "подозрителен за инвазия" е подходящ, когато хистологичните критерии за инвазивна злокачественост са неясни. До 80% от случаите с интраепителна неоплазия могат да прогресират до инвазия, като инвазивен рак вече може да присъства при пациенти с високостепенна интраепителна дисплазия, но няма видима туморна маса.
Диференциална диагноза
Диференциалната диагноза на интраепителната неоплазия и ранния инвазивен карцином включва псевдоинвазии (кохезивен тип като при дълбок кистичен гастрит; дифузен тип, както при NHL-MALT-лимфом [NHL-Non-Hodgkin Lymphoma, Неходжкинов лимфом; MALT — mucosa-associated lymphoid tissue, мукозо-асоциирана лимфна тъкан], с разпръснати епителни структури, имитиращи инвазивен епителен растеж).
Друга диференциална диагноза включва невроендокринни тумори и реактивни промени, както е при химическия реактивен гастрит. Особено важно е изключването на NSAID (Non-steroidal anti-inflammatory drugs, Нестероидни противовъзпалителни средства)/ASA (acetylsalicylic acid, ацетилсалицилова киселина)-индуцирани (предизвикани) лезии.
Много е трудно да се направи разлика въз основа на хистологичните резултати между реактивни или регенеративни проблеми, възпаление и неопластични промени, интраепителни и инвазивни тумори. Ето защо стомашната неоплазия, диагностицирана като неинвазивна и интраепителна, често се развива в инвазивен карцином по време на проследяването.
Клинично, разграничаването на стомашната високостепенна интраепителна дисплазия и аденокарцином не играе роля, защото и при двете поражения, след внимателно стадиране, изискват ендоскопска резекция, а повечето лезии би трябвало да се разглеждат като лигавични карциноми, а не като високостепенна интраепителна неоплазия.
Точното описание на термина инвазия липсва в европейската и американската литература.
В класификацията на СЗО като инвазия се определя наличието на експанзия (разрастване) на атипични клетки през базалната мембрана или дори на експанзия в анатомични структури (например в колоректални тумори).
Критериите за по-напреднали лезии са:
- експанзия на атипични клетки през базалната мембрана;
- разпространението на единични туморни клетки;
- стромална фиброзна реакция;
Наличието или отсъствието на базални мембрани корелира със степента на тумора.
Наличието на фиброзни стромални реакции около неопластичните тубули е важен критерий, но те често се откриват в лезии, които вече са проникнали в субмукозния слой. Тази стромална фиброзна реакция е най-добре изразена в субмукозния и субсерозния (един от подслоевете на външната обвивка на стомаха) слой, следователно аденокарциноми почти никога не показват такава фиброзна реакция. В muscularis mucosae реакцията е по-слабо изразена.
Фибробластите на фиброзната околотуморна реакция са по-слабо диференцирани в сравнение с перитубуларните фибробласти.
Лезиите на лигавицата при дифузните стомашни карциноми много рядко показват фиброзна стромална реакция. Основната характеристика на добре диференцирания аденокарцином е наличието на неповърхностна латерална интертубуларна (между тубулите) експанзия, която показва необичайни разклонения от тубулни клончета, което води до притискане на съседна тъкан (жлези, капиляри), последваща атрофия на съседни жлези, както и спиране на нормалните клетъчни движения по време на диференциация и пролиферация.
Ако стволови клетки на стомашната лигавица, които са разположени в непосредствена близост до повърхността, са увредени от тумора, не може да бъде открита по-нататъшна регенерация (възстановяване). Поради липса на регенерация, в аденокарциномите могат да възникнат:
- субепителен (под епитела) растеж на ракови тубули;
- притискане на капиляри;
- повърхностно увреждане;
Диагноза
Ендоскопията е най-чувствителният и специфичен диагностичен метод за изследване на стомашни тумори. Възможно е да се открият незначителни промени в цвета и структурата на лигавичната повърхност, които предполагат ранен рак на стомаха. Използваните методи са високорезолюционна ендоскопия и теснолентов светлинен режим (NBI) с хромоендоскопия.
Златен стандарт при поставянето на хистологична диагнозата обаче си остава вземането на биопсични проби и по-специално ендоскопската форцепс-бипсия, но и тя е недостатъчна за окончателна диагноза и планиране на лечението при пациенти със стомашна интраепителна неоплазия. В някои случаи се прави и ултрасонографска оценка на дълбочината на инвазия, за да се преценят пораженията, нанесени от ранния стомашен рак.
Ендоскопските резултати трябва да бъдат съобразени с диагнозата неоплазия и трябва да бъдат внимателни разгледани.
Патологичната диагноза, поставена при биопсична проба, понякога е затруднена и се поставя по-лека диагноза, когато е в сравнение с диагнозата, поставена при резецирани проби. Причините за трудностите, срещани при поставянето на точната диагноза въз основа на биопсични проби, са:
- структурната атипия както на аденомите, така и на добре диференцираните аденокарциноми е твърде слабо изразена, за да се открие в малки биопсични проби;
- карциномът понякога е фокално (огнищно) разположен в лезията, което може да доведе до грешка при диагностицирането на биопсичната проба;
- регенерирането на атипията, предизвикана от гастрит, предизвиква хистологична модификация;
В някои случаи активното възпаление на стомашната лигавица, инфектирана с Helicobacter pylori, може да "скрие" неопластично структурно нарушение и да доведе до фалшиво отрицателни резултати.
Някои ендоскопски находки могат да подскажат за евентуалното развитие на злокачествени заболявания от високорискови лезии:
- диаметър > 20 mm;
- плосък макроскопски вид;
Конвенционалната ендоскопска диагностика, базираща се единствено на размера на лезията, не е достатъчна, за да се направи точна предоперативна диагноза. Освен това, появата на аденом върху повърхността може да бъде важен фактор за диагностика на злокачествено заболяване.
Лечение
Съществуват два терапевтични принципа при стомашната интраепителна неоплазия:
- според първия, интраепителната неоплазия трябва да се третира като доброкачествена лезия, освен ако биопсичните проби не покажат категорично злокачествена находка;
- вторият принцип е свързан с третирането на интраепителната неоплазия активно, като "диагностична терапия";
Има няколко насоки, свързани с лечението на стомашната интраепителна неоплазия. От 2000 г. насам, ревизираната Виенска класификация насочва за правилното клинично лечение на предраковите стомашни заболявания.
Лезиите от категория 4 (високостепенна дисплазия и карцином in situ) трябва да се резецират, защото притежават по-голям потенциал за развитието на аденокарцином.
От друга страна обаче, няма точни насоки за третиране на нискостепенната интраепителна неоплазия.
Естественият ход на стомашната интраепителна неоплазия остава неясно. Сегашните данни показват, че над 40% от нискостепенните интраепителни неоплазии се диагностицират като аденокарцином след резекция.
Като допълнение към оптичните методи в ендоскопията, както и за по-добри резултати, се прилага ендоскопска субмукозна (на подлигавицата) дисекция (ESD), а не ендоскопска мукозна (лигавична) резекция (EMR), защото проба, взета с ESD, има отрицателни за туморни клетки резекционни ръбове, т.е. е по-лесно да се оценят атипичните структури, дори ако има по-слабо изразена ядрена атипия.
Тези факти означават, че дори нискостепенната интраепителна неоплазия не може да се третира само като премалигнена (предракова) лезия, но също и като лезия, която вече съдържа ракови огнища и проследяването на пациента може да доведе до пропускане на възможността за ендоскопска терапия.
Повторните ендоскопски изследвания с вземане на биопсии обаче натоварват пациента физиологично, психологично и финансово.
EMR с примка дава възможност за по-точно хистопатологично диагностициране в сравнение с форцепс-биопсията, защото лезията може да бъде отстранена като едно голямо парче.
Приложението на EMR е ограничено, тъй като понякога води до многократна частична резекция, а това може да доведе до ефект на изгарянето при хистологичните образци, което пречи на точната патологична диагноза, а освен това може да настъпи и локален рецидив (честота около 10%).
Честотата на усложненията при ESD е относително ниска.
ESD дава възможност за една по-сигурна резекция на по-големите поражения, което води до по-точна диагноза, тъй като резекционните ръбове са по-големи от тези на EMR.
ESD изисква повече умения, причинява повече усложнения (например перфорация, пробив), по-продължителна процедура е, но честота на пълната en bloc (анблок) резекция е 97%.
Ендоскопската резекция трябва да се разглежда не само като окончателно лечение, но също така и като процедура за точна хистологична диагноза при лезии, първоначално диагностицирани при форцепс-биопсията като стомашна интраепителна неоплазия.
Ретроспективният анализ на ракови проби, взети при гастректомия (премахване на част или на целия стомах), изиграва решаваща роля при установяването на връзката между диспластичния епител и аденокарцинома на стомаха и в предполагаемата роля на епитела като прекурсорна лезия.
Проследяването на пациентите и периодичното извършване на ендоскопии и бипсии е важно при пациенти с премалигнени лезии и може да доведе до ранното откриване на рак.
Страните, в които асимптоматичните пациенти се подлагат на скрининг, имат висока честота на EGC (ранен стомашен рак), варираща от 30 до 50%.
Библиография
https://www.intechopen.com/books/gastric-carcinoma-new-insights-into-current-management/gastric-carcinoma-morphologic-classifications-and-molecular-changes
Коментари към Карцином in situ на стомах МКБ D00.2