Миокардит при други инфекциозни и паразитни болести, класифицирани другаде МКБ I41.2

Човешките паразитни инфекции са повсеместни и засягат значителен брой индивиди по целия свят. Протозойните и хелминтните паразити могат да доведат до широк спектър от клинични прояви по време на миграцията им вътре в човешкото тяло или когато стигнат до крайния си орган на инфекция. Освен това някои паразитни инфекции са свързани със значителна заболеваемост и смъртност в райони с висока ендемичност.
Сърцето и белите дробове са вътрешни органи по-често засегнати от паразитни инфекции. Участието на сърцето може да е част от по-генерализирано заболяване. В други ситуации паразитните инфекции могат да имат по-директни ефекти върху различни структури на сърцето (миокард, перикард, ендокард или сърдечна васкулатура). Участието на миокарда може да доведе до миокардит или различни видове кардиомиопатии (тоест дилатирани или рестриктивни). Латентните паразитни инфекции могат също така да се активират и да се проявят като системно заболяване, често в крайна сметка засягащо сърцето, при имуносупресивни състояния като трансплантация на органи, използване на имуносупресивни агенти или ХИВ/СПИН. Поради нарастващата миграция, разселването на населението и пътуванията, клиницистите навсякъде по света трябва да са наясно с потенциалните сърдечни прояви на паразитни заболявания. В тази връзка кардиомиопатията на Chagas е отличителна черта на заболяване, което в момента се счита за глобална паразитна болест.
Заболяване на сърдечната мускулна тъкан (миокарда), което се характеризира с наличие на инфекциозно възпалителен процес, се нарича миокардит при други инфекциозни и паразитни болести, класифицирани другаде. Към тази рубрика спадат токсопазмен миокардит и миокардит при болест на Chagas.
Епидемиология
Trypanosoma cruzi е ендемичен в Южна Америка, Централна Америка и части от Северна Америка (Южна САЩ и Мексико). В исторически план болестта се е отразила непропорционално на бедните, тъй като предаването на инфекцията с T. cruzi се е случило главно в селските райони, където хората живеят в къщи с лошо качество и в тесен контакт с потенциални вектори. Въпреки това миграциите между селските и градските райони и международните промени са променили епидемиологията на болестта на Chagas, засягайки периферните райони, градските райони, районите на ендемичност и районите с неендемичност. В резултат на тези динамични промени в населението и на координираните усилия на страните, в които болестта е ендемична за прекъсване на векторално и трансфузионно предаване, разпространението и честотата на заболяването постоянно се променят. През 80-те години се смята, че общото разпространение на инфекцията с T. cruzi достига 17 милиона случая в 18 страни, където заболяването е ендемично, като 100 милиона души са изложени на риск. Според най-новите оценки, в момента в Латинска Америка са заразени от T. cruzi 7,6 милиона души. Въпреки че не са налични точни данни, документиращи общата тежест на сърдечното засягане с T. cruzi, може да се предположи, че 20 до 30% от 7,6 милиона заразени лица са или потенциално ще развиват хронични сърдечни лезии. Смята се, че кардиомиопатията на Chagas представлява основната причина за сърдечната заболеваемост и смъртност сред младите възрастни в страни, където T. cruzi е ендемичен и се смята, че води до най-малко 21 000 смъртни случаи всяка година. Освен това, поради постоянния приток на имигранти от страни, където болестта е ендемична, болестта на Chagas се превръща във важен здравен проблем в Северна Америка (САЩ и Канада) и много части на Европа, където все по-голям брой хора се подозират, че да бъдат заразени (напр. 300 000 индивида в САЩ и 48 000 до 67 000 индивида в Испания).
Toxoplasma gondii е световна зооноза, способна да причини няколко различни клинични синдрома у имунокомпетентните и имунокомпрометирани индивиди. T. gondii е паразит на членовете на семейството на котките, като хората и други топлокръвни животни служат като междинни домакини. Хората се заразяват или от яденето на недоготвено месо, поглъщането на замърсена вода, фекално-оралното предаване от котешки фекалии, вродено чрез трансплацентарно предаване, кръвопреливане или трансплантация. Месото за консумация от човека не се проверява рутинно за инфекция с T. gondii в Съединените щати или другаде по света. Предаването от човек на човек не се случва, с изключение на предаването от майка на плода. Честотата на антителата срещу T. gondii нараства с увеличаване на възрастта, но не варира между половете. Разпространението на титри на антитела варира значително в различните географски региони и в дадена популация. Установено е, че общата серопреносимост сред юноши и възрастни в Съединените щати е 22,5%, като серопреносимост сред жени в детеродна възраст (от 15 до 44 години) от 15%. В Съединените щати серопозитивността на T. gondii сред заразените с ХИВ индивиди варира от 10% до 45% и корелира със серопозитивността в не-заразеното с ХИВ население. В Западна Европа и Африка серопреносимостта сред заразеното с ХИВ население е приблизително от 50% до 78%.
Етиология
Болестта на Chagas, известна още като американска трипанозомоза, е зоонозна тропическа болест, причинена от паразит Trypanosoma cruzi. Повечето инфекции се осъществяват чрез пренос на вектори от триатоминови насекоми в райони с ендемичност, но могат да се появят и чрез кръвопреливане или трансплантация на органи, вертикално от майка на бебе и, по-рядко, чрез поглъщане на храна или течност, замърсена с Т. cruzi или инциденти сред лабораторния персонал, който работи с живи паразити. Пренасянето чрез вектори включва предаване на инфекциозната форма на паразита (метацикличните трипомастиготи) на хората чрез екскретите на триатоминовото насекомо през лигавиците или чрез наранена повърхност на кожата. След това трипомастиготите нахлуват в локалните клетки гостоприемници, където се диференцират в амастиготи и се размножават в клетката. Когато клетката е набъбнала с амастиготи, те се трансформират обратно в трипомастиготи. Трипомастиготите лизират клетките, нахлуват в съседни тъкани и се разпространяват чрез лимфата и кръвообращението до далечни места. Цикълът завършва, когато насекомото се зарази чрез поглъщане на кръв от заразен гостоприемник. Малцина от пациентите ще развият остър синдром с продължителност от 4 до 8 седмици, който неизменно включва продължителна треска в допълнение към променливо съзвездие от симптоми, които включват възпаление на входа на инфекцията, подкожен оток (локализиран или генерализиран), лимфаденопатия, хепатоспленомегалия, миокардит и по-рядко менингоенцефалит. Проявите на острата фаза отшумяват спонтанно за по-голямата част от индивидите, дори ако инфекцията не се лекува с антипаразитно лекарство. Около 60 до 70% от тези пациенти никога няма да развият клинично очевидни заболявания. Те остават безсимптомни и заразени през целия живот, като се разпознават само ако се извършват серологични тестове (така наречената неопределена форма на хронична болест на Chagas). Приблизително 30 до 40% от заразените пациенти впоследствие ще развият сърдечната и/или храносмилателната (мегаезофаг и мегаколон) форма на хронична болест на Chagas, обикновено 10 до 30 години след първоначалната инфекция.
Toxoplasma gondii е облигатен вътреклетъчен паразитен едноклетъчен еукариот, който причинява инфекциозната болест токсоплазмоза. Жизненият цикъл на T. gondii може да бъде обобщен като цяло в два компонента: сексуален компонент, който се среща само в рамките на котки (фелиди, диви или домашни), и асексуален компонент, който може да се наблюдава в почти всички топлокръвни животни, включително хора, котки и птици. Тъй като T. gondii може да се възпроизвежда по полов път само в рамките на котките, следователно котките са окончателният гостоприемник на T. gondii. Всички останали гостоприемници - при които може да се наблюдава само асексуално възпроизвеждане - са междинни хостове.
През различни периоди от жизнения си цикъл отделните паразити се превръщат в различни клетъчни стадии, като всеки етап се характеризира с ясно изразена клетъчна морфология, биохимия и поведение. Тези етапи включват тахизоитите, мерозоитите, брадизоитите (открити в тъканните кисти) и спорозоитите (открити в ооцисти).
Подвижните и бързо размножаващи се тахизоити са отговорни за разширяването на популацията на паразита в гостоприемника. Когато гостоприемник консумира тъканна киста (съдържаща брадизоити) или ооциста (съдържаща спорозоити), брадизоитите или спорозоитите се превръщат в тахизоити при заразяване на чревния епител на гостоприемника. По време на първоначалния остър период на инфекция тахизоитите се разпространяват по тялото чрез кръвния поток. По време на по-късния, латентен (хронични) стадии на инфекция, тахизоитите стадий се превръщат в брадизоити, за да образуват тъкани кисти.
Подобно на тахизоитите, мерозоитите се разделят бързо и са отговорни за разширяването на популацията на паразита вътре в червата на котката преди сексуално размножаване. Когато котешкият гостоприемник консумира тъканна киста (съдържаща брадизоити), брадизоитите се превръщат в мерозоити вътре в червата епителни клетки. След кратък период на бързо нарастване на популацията в чревния епител, мерозоитите се превръщат в неинфекциозни сексуални етапи на паразита, за да се подложат на полово размножаване, което в крайна сметка води до съдържащи зигота ооцисти.
Брадизоитите са бавно разделящият се стадий на паразита, който съставя тъкани от кисти. Когато незаразеният гостоприемник консумира тъканна киста, брадизоитите, освободени от кистата, заразяват чревните епителни клетки, преди да се превърнат в стадий на пролиферативния тахизоит. След първоначалния период на пролиферация в цялото гостоприемно тяло, след това тахизоитите се превръщат обратно в брадизоити, които възпроизвеждат вътре в клетките на гостоприемника, за да образуват тъкани кисти в новия гостоприемник.
Спорозоитите са стадийът на паразита, пребиваващ в ооцистите. Когато човек или друг топлокръвен гостоприемник консумира ооциста, спорозоитите се освобождават от него, заразявайки епителните клетки, преди да се превърнат в стадий на пролиферативния тахизоит.
Патогенеза
Първоначално изобилието от паразити, свързани с острата фаза на инфекцията с T. cruzi, се аргументира в полза на прякото влияние на паразита при увреждане на тъканите и миокардит, наблюдавани по време на този стадий на заболяването. Скоро след това демонстрация на миоцитолиза на непаразитизирани кардиомиоцити доведе до последиците от насочени срещу паразити клетъчни имунно-медиирани възпалителни увреждания. Това имунно медиирано увреждане, свързано с голям брой амастиготи в сърдечните миоцити, се превръща в хиалиновата дегенерация на мускулните влакна, коагулационната некроза на миоцитите и околните тъкани, както и участието на епикарда и перикарда. Клетъчните и евентуално хуморалните имунни реакции, предизвикани от паразита, в крайна сметка контролират острата инфекция, но не успяват напълно да елиминират паразита. След това настъпва променливо дълга асимптоматична фаза, при която фактори като паразитния щам, натоварването с паразити по време на острата фаза, качеството на имунния отговор и наличието или отсъствието на реинфекция могат да повлияят на хода на хроничното заболяване. По отношение на патогенезата на интерстициалната фиброза, миоцитолизата и продължаващата лимфоцитна инфилтрация, наблюдавана за хроничната фаза на болестта на Chagas, слабостта на паразитите в сърдечната тъкан вероятно отразява използването на нечувствителни хистологични техники през последните десетилетия.
Съществуват доказателства за множество хипотези, които обясняват етиологията на хроничните сърдечни лезии, които влияят директно на паразита, имунната реакция към паразита и автоимунитета, предизвикан или директно от паразита (мимикрия), или индиректно (активиране от страна на наблюдателя). Продуктите на тези лезии са различни степени на некроза, увреждане на невроните, увреждане на микросъдовете и фиброза. Допринасящата роля на всеки механизъм за патогенезата на кардиомиопатията на Chagas е съвсем друга тема на разискване.
В допълнение към увреждането на невроните, микроциркулаторните промени, водещи до исхемия, също са замесени в патогенезата на хроничната кардиомиопатия на Chagas. Наблюдава се дифузен колапс на интрамиокардиални артериоли в сърцата на хронично заразени пациенти. Оклузивни тромбоцитни тромби в малки епикардни и интрамурални коронарни артерии и повишено производство на цитокини и медиатори, които насърчават вазоспазма и агрегацията на тромбоцитите, са демонстрирани с експериментални модели на болестта на Chagas.
Както бе споменато по-горе, увреждането на тъканите, причинено директно от паразита или, по-вероятно, от имунния отговор, предизвикан от него, е постулирано, за да бъде в основата и потенцира агресията към сърдечните миоцити и неврони. Възпалителният инфилтрат в хроничната кардиомиопатия на Chagas включва преобладаване на макрофаги, CD8 + и CD4 + лимфоцити (в съотношение 2:1), а в някои случаи е доказано, че той корелира с по-напредналите стадии на заболяването. Счита се, че персистирането на паразити и антигени участва в набирането на специфични за T. cruzi CD8 + T лимфоцити, които преобладават в миокардния инфилтрат в случаи на хроничен миокардит на Chagas. Въпреки това, точният механизъм, отговорен за повратна точка от имунозащита до имуно-медиирана агресия, водеща до необратимо увреждане на тъканите, остава неуловим: не само валидността на паразитите е както за симптоматични, така и за безсимптомни пациенти, но наличието на паразита в сърдечната тъкан невинаги корелират с възпалението.
Toxoplasma gondii се размножава вътреклетъчно на мястото на инвазията и може да се разпространи в отдалечени органи чрез инвазия на лимфата и кръвта. Образуването на тъканни кисти възниква през първата седмица от инфекцията и е отговорно за латентната инфекция. T. gondii пребивава вътреклетъчно във фагозоми в макрофагите и миокардните клетки. Паразитът се задвижва чрез механизъм за подвижност на плъзгаща подвижност, зависим от актин-миозин и създава вътреклетъчни вакуоли. Това ремоделиране предотвратява сливането на лизозомите, което води до вътреклетъчното оцеляване на паразита. Имунната компетентност на индивида е определящият фактор за набирането на латентна инфекция. Имунитетът при имунокомпетентния индивид остава за цял живот. Т клетки, макрофаги и цитокини от тип 1 са от решаващо значение за контрола на инфекцията с T. gondii. Дефектното производство на IFN-? и интерлевкин-12, вероятно медиирано от CD40 лиганд, може да играе роля при липса на ограничаване на инфекцията. Цитокиновата стимулация на производството на макрофаги на реактивни азотни междинни продукти е хипотезирана, за да подпомогне контрола на гостоприемника на установена инфекция. Както гостоприемника, така и паразитната генетика изглежда са важни за патогенезата на заболяването.
Клинична картина
Острият миокардит, както се доказва от аутопсионни проучвания, вероятно се случва при близо 100% от пациентите с остра болест на Chagas. Съществува обаче огромно разминаване между резултатите от аутопсията и клиничните данни: първо, защото острата инфекция протича безсимптомно в приблизително 90 до 95% от случаите и второ, защото дори при пациенти със симптоматика, острият миокардит се диагностицира само за 1 до 40% от тях. Констатациите при сърдечна аускултация могат да включват тахикардия (невинаги пропорционална на степента на треска), сърдечни шумове и приглушени сърдечни звуци. Основните промени в електрокардиограмата (ЕКГ) са атриовентрикуларен блок от първа степен, нисък Q-R-S интервал на ЕКГ и първични промени на Т-вълната. Рентгенографията на гръдния кош може да показва различна степен на кардиомегалия, а перикардният излив е най-често съобщаваната ехокардиографска аномалия. След острата фаза повечето пациенти се връщат към нормален или почти нормален статус на миокарда, но някои пациенти (30%) след това хронично развиват фиброзиращ миокардит.
Сърдечното засягане е най-честата и най-тежка проява на хронична болест на Chagas. Преходът от неопределената форма към сърдечната форма на хронична болест на Chagas обикновено се проявява чрез появата на промени в ЕКГ, като непълен или пълен десен клон на снопа, ляв преден фасцикуларен блок, минимален ST-T интервал на ЕКГ и мономорфни преждевременни вентрикуларни контракции, най-вече при асимптоматични или олигосимптомни пациенти (фигура 1). С напредването на заболяването могат да се свържат дефекти на интравентрикуларната проводимост, брадиаритмии, висококачествени атриовентрикуларни блокове, Q вълни, неустойчива или устойчива камерна тахикардия и в крайна сметка предсърдно трептене или фибрилация. 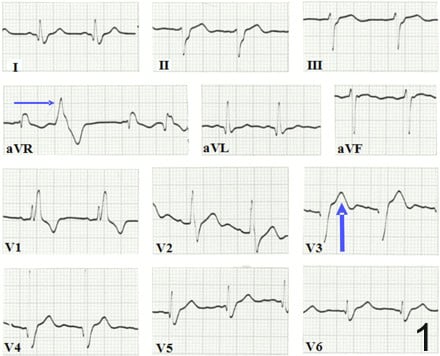 Симптоми като сърцебиене, атипична болка в гърдите, пресинкоп, синкоп, задух при натоварване и оток обикновено се наблюдават през целия курс на хронична кардиомиопатия на Chagas.
Симптоми като сърцебиене, атипична болка в гърдите, пресинкоп, синкоп, задух при натоварване и оток обикновено се наблюдават през целия курс на хронична кардиомиопатия на Chagas.
Клиничната експресия на токсоплазмоза зависи от нивото на имунитет при човешкия гостоприемник. При имунокомпетентните пациенти острата токсоплазмоза най-често е безсимптомна, но латентната инфекция може да продължи цял живот. Латентната инфекция се дължи на образуване на киста и впоследствие може да се активира отново при лица с имунокомпрометиране. Сред тези популации токсоплазмозата често се представя под формата на енцефалит или хориоретинит. Миокардитът рядко се съобщава като проява на остра токсоплазмоза. Това проявление може да се прояви изолирано или като част от по-широк клиничен спектър на заболяването. Описани са перикарден излив, констриктивен перикардит, аритмии и застойна сърдечна недостатъчност при пациенти с миокардит на T. gondii. При пациенти със СПИН сърцето е вторият най-често засегнат орган след мозъка. Преобладаването варира в зависимост от различни проучвания и диагнозата обикновено се поставя след смъртта, тъй като сърдечното засягане обикновено е клинично безшумно или доминирано от прояви на централна нервна система. Приблизително 12 до 22% от пациентите със СПИН имат данни за ендомиокардно засягане от T. gondii при аутопсия.
Свързаният с токсоплазма гондии миокардит може да възникне и при пациенти с трансплантация поради реактивация или де новоинфекция от серопозитивен донор до серонегативен реципиент. Всъщност токсоплазмозата е най-често съобщаваната паразитна болест, възникваща след сърдечна трансплантация и може да симулира отхвърляне на органи. Дисеминираната токсоплазмоза със свързан миокардит може да доведе до фатален изход, ако не се дава предварителна профилактика на пациенти с трансплантация органи.
Диагноза
Диагнозата на острия миокардит на Chagas зависи от демонстрацията на паразита и/или анти-Т. cruzi IgM при пациент с правилния епидемиологичен произход и клинична картина. IgM серологичните анализи не са широко достъпни в развиващите се страни и не са стандартизирани, така че диагнозата обикновено се поставя чрез визуализиране на трипомастиготите в мазнини с прясна кръв, препарати с гъста капка или намазки с тънка обвивка. Нивото на паразитемия намалява до почти неоткриваеми нива от 6-та до 10-та седмица на инфекцията, което прави идентифицирането на паразити в периферната кръв изключително трудно по това време. Диагнозата може да се опита и чрез хемокултура на специализирана среда (която има подобрена чувствителност спрямо директен преглед) или ксенодиагностика (която включва откриване на паразита чрез заразяване на лабораторно отгледани триатоминови насекоми директно или косвено с кръвта на пациента). Въпреки това, дори като се има предвид само вродената болест на Chagas, хемокултурата рядко се извършва за диагностициране на остра инфекция, тъй като изисква специализирана лаборатория и обучен персонал и обикновено не е широко достъпна. Индиректните паразитологични тестове имат ограничена стойност при диагностицирането на острата болест на Chagas, тъй като те могат да отнемат повече от 1 месец за получаване на резултати (забавяне на началото на трипаноцидната терапия).
Диагнозата на хронична кардиомиопатия на Chagas трябва да се подозира при млади пациенти, които имат сегментарна или дилатативна кардиомиопатия с неизвестна етиология, ако са в области на ендемичност или в правилния епидемиологичен контекст. Предвид ниската и вероятно прекъсваща паразитемия в хронична фаза, диагнозата разчита на серологични методи чрез откриване на IgG, който се свързва с антигените на T. cruzi. Ензимно-свързаният имуносорбентен анализ (ELISA), индиректната имунофлуоресценция и индиректната хемаглутинация са най-често използвани. Два положителни теста, използващи някоя от трите конвенционални техники, се препоръчват за окончателна диагноза. Идентифицирането на паразита чрез хемокултура или ксенодиагностика в хроничната фаза на заболяването се възпрепятства от ниската чувствителност на методите, която зависи пряко от нивото на паразитемия. Тези методи обаче могат да имат роля за потвърждаване на диагнозата в редки случаи на серологично съмнителни резултати.
Първоначалната оценка на току-що диагностицирания пациент с хронична инфекция с T. cruzi включва пълна медицинска анамнеза и физикален преглед и електрокардиограма в покой. Асимптоматичните пациенти с нормална ЕКГ имат благоприятна прогноза и трябва да бъдат проследявани само годишно или на всеки две години. Пациентите с промени в ЕКГ, съответстващи на хронична кардиомиопатия на Chagas, трябва да преминат рутинна сърдечна оценка, включително амбулаторен 24-часов монитор на Холтер (допълнен с тест за упражнения, когато е възможно) за откриване на аритмии и оценка на функционалния капацитет, рентгенография на гръдния кош и ехокардиография за оценка камерна функция и други кардиологични тестове. Въз основа на резултатите от тези тестове е възможно да се разслоят отделните пациенти по риск и да се приложи подходяща терапия.
Диагнозата токсоплазмоза разчита на серологията или идентифицирането на тахизоитите в миокардната тъкан. Имуноглобулин G антителата се появяват рано, пик в рамките на 6 месеца след инфекцията и остават откриваеми за цял живот. Тестът за отрицателни IgG антитела по същество изключва предишна или скорошна инфекция на имунокомпетентен гостоприемник. Имуноглобулин M антителата могат да съществуват години след инфекция и не трябва да се използват като единствен диагностичен критерий за скорошна инфекция. Тестът за наличие на антитела се оказа много полезен като маркер за времето на инфекция. Този тест е най-полезен по време на бременност, където допълнителната оценка и лечение зависят от времето на инфекция спрямо бременността. Не е достатъчен нито един серологичен тест, който да подкрепи диагнозата на остра или хронична токсоплазмоза и често се изисква използването на референтна лаборатория. Пациентите могат да имат лека лимфоцитоза и нивата на чернодробната трансаминаза могат да бъдат леко повишени. В противен случай лабораторните резултати не са специфични.
Лечение
Само две лекарства, бензнидазол и нифуртимокс, се препоръчват за лечение на болестта на Chagas, спадаща към миокардит при други инфекциозни и паразитни болести, класифицирани другаде. От двете, бензнидазол (производно на нитроимидазол) е изследван по-широко в клинични проучвания и се понася по-добре като цяло. Нежеланите реакции като генерализиран или понякога локализиран алергичен дерматит се проявяват при приблизително 20 до 30% от пациентите и се състоят от сърбежни и небулозни полиморфни еритематозни обриви, често последвани от десквамация.
Лечението се препоръчва за всички случаи на остра и вродена инфекция, реактивирана инфекция и ранна хронична болест на Chagas (особено деца/юноши) въз основа на доказателства за съкращаване на клиничния курс на заболяването, излекуване на инфекция или намаляване на броя на паразитите. За заразени възрастни без напреднала кардиомиопатия до 50-годишна възраст обикновено трябва да се предлага и етиологично лечение. Обосновката на тези препоръки произтича от доказателства за забавяне на прогресията на кардиомиопатия.
За разлика от това етиологичното лечение е противопоказано по време на бременност и при пациенти с тежка бъбречна или чернодробна недостатъчност и обикновено не трябва да се предлага на пациенти с напреднала кардиомиопатия или мегаезофагус със значително увреждане на преглъщането. При хронична болест на Chagas лечението се документира, когато преди това положителните серологични тестове са отрицателни, обикновено години или десетилетия след лечението.
Медицинското лечение на сърдечна недостатъчност при пациенти с хронична кардиомиопатия на Chagas трябва да следва специфични лечения, насочени на всеки етап, съгласно настоящите указания за сърдечна недостатъчност на други етиологии. Важно изключение е използването на бета блокери, които трябва да се използват с повишено внимание при хронична кардиомиопатия на Chagas поради по-висока честота на дефекти на атриовентрикуларната проводимост и свързаните с тях брадиаритмии. Сърдечната трансплантация е извършена с добри резултати при пациенти с напреднала хронична кардиомиопатия на Chagas, но може да не е налична или достъпна във всички страни, където това заболяване е ендемично.
Лечението на избор при токсоплазмозен миокардит се основава на комбинация от пириметамин и сулфадиазин или пириметамин и клиндамицин. Левковорин трябва да се дава на всички пациенти, приемащи пириметамин. Комбинации от пириметамин и азитромицин или атовакван могат да се считат за пациенти с непоносимост към други схеми въз основа на данни от имуносупресирани пациенти. Комбинацията от пириметамин и сулфадиазин също е схема за лечение на първа линия по време на бременност. Въпреки това, съществуват алтернативи за тези, които са загрижени за потенциална токсичност и тератогенност, а изборът на лечение се влияе от продължителността на бременността и документирането на инфекцията на плода. Серологичен скрининг на донори и реципиенти на органи преди трансплантация позволява идентифициране на пациенти с най-висок риск от токсоплазмоза и осигуряване на профилактика за тези лица. Оптималният график за осигуряване на профилактика на триметоприм-сулфаметоксазол в обстановката за трансплантация не е определен. Обаче това лекарство често се прилага ежедневно или три пъти седмично. Профилактиката е важна за серонегативни бременни жени и имунодефицитни пациенти.
Библиография
https://cmr.asm.org/content/23/2/324
https://en.wikipedia.org/wiki/Toxoplasma_gondii
https://www.webmd.com/heart-disease/myocarditis
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5951175/
Коментари към Миокардит при други инфекциозни и паразитни болести, класифицирани другаде МКБ I41.2