Глутенова ентеропатия
Глутеновата ентеропатия, или наричана още нетропическо спру или цьолиакия, е резултат от анормален имунен отговор към глиадин, компонент на хранителния глутен, който се среща в пшеница, ечемик, ръж и вероятно овес. Това причинява атрофия на лигавицата на лигавицата на тънките черва, което от своя страна води до малабсорбция и предразположение към стомашно-чревни злокачествени заболявания, особено карцином на орофаринкса и хранопровода и лимфома на тънките черва. Заболяването може да се прояви както при деца, така и при възрастни, но е рядкост в юношеството и проявите му може да изчезнат на тази възраст.
Въпреки че заболяването е официално описано в края на 19-ти век, лечението остава емпирично до средата на 20-ти век, когато пациентите са забелязали, че се подобряват драстично, след като пшеницата е била отстранена от диетата. С развитието на техники за биопсия на червата, тънките черва бяха идентифицирани като целеви орган. Последните проучвания на населението показват, че глутенова ентеропатия е по-често срещано, отколкото се смяташе преди. Някои пациенти имат минимални или никакви симптоми.
Клинично се проявява с диария, загуба на тегло, стеаторея и лошо храносмилане. В някои случаи се доказва желязодефицитна анемия, остеомалация и склонност към кръвоизливи поради хипопротромбинемия. Клиничната симптоматика може да изчезне при диета, несъдържаща глутен.
Погълнатият протеин обикновено не провокира имунен отговор. Това явление се нарича "орална толерантност". Пациентите, които показват истинска алергия към погълнат протеин (например мляко или соев протеин), имат типичен IgE-медииран отговор, състоящ се от уртикария, ангиоедем и бронхореактивност.
Автоимунитетът при глутенова ентеропатия включва плазмени клетки, които произвеждат IgA и IgG. Има малко или никакво участие на IgE. Текущата теория предполага, че поглъщането на алфа-глиадин (компонент на глутеновия протеин) и свързаните с него пептиди се свързва с тъканна трансглутаминаза в ентероцитите. Алфа-глиадинът е богат на глутамин. Трансглутаминаза деамидира глутаминови остатъци, образувайки глутаминова киселина. Дезамидирането повишава имуногенността на алфа-глиадин чрез създаване на епитопи, които са признати като чужди от имунитет, медииран от клетката-приемник.
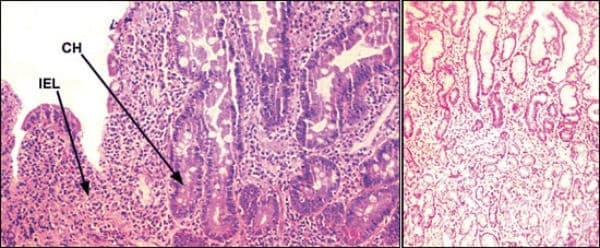
Плазмените клетки продуцират IgA и IgG, които са насочени срещу различни антигени, включително трансглутаминаза, ендомизий, глиадин и ретикулин. Разработени локално лимфокини привличат възпалителни клетки. Тази интензивна локална възпалителна реакция произвежда изравняване на вили, характерно за глутен-чувствителната ентеропатия. Следва малабсорбция на микронутриенти (например, витамини и минерали) и макронутриенти (например, протеин, въглехидрат, мазнина). Участието на тънките черва е най-ясно изразено проксимално и може да бъде "неравномерно", особено при пациенти с "тиха" цьолиакия (тоест минимални или без симптоми).
Когато глиадин влезе в лигавицата на тънките черва, той се подлага на ензимно деамидиране чрез тъканна трансглутаминаза, екстрацелуларен ензим, намерен в съединителната тъкан на тънките черва. При чувствителните хора, комплексът глиадин- трансглутаминаза става антигенен, предизвиквайки локален имунен отговор. Това води до характерната атрофия на вилите при глутенова ентеропатия. Като част от тази имунна реакция се произвеждат антитела към трансглутаминаза и се разпознават като ендомиални антитела.
Глутеновата ентеропатия засяга основно лигавицата на тънките черва. Обикновено не участват субмукоза, мускуларис и сероза. Вилите са атрофични или липсват с намалено съотношение на вила-към-крипта (нормално съотношение 4-5:1) и криптите са хиперпластични. Клетъчността на lamina propria се увеличава с пролиферация на плазмени клетки и лимфоцити. Броят на интраепителните лимфоцити на единица дължина на абсорбиращия епител е увеличен (съотношение на нормалния интраепителен лимфоцит към епител е 1:10).
Един от първите опити за хистопатологично класифициране на глутенова ентеропатия е предложен от Рубин. Като се имат предвид характеристики като епителна повърхностна площ, отразена от височината на вилите, както и епителни аномалии и инфилтрация на lamina propria от възпалителни клетки, те предлагат лезиите се оценяват като леки, умерени или тежки.
Вероятно най-важният напредък в класифицирането на лезии при заболяването е препратен от Марш, който предлага серия от взаимосвързани лезии, които интегрират патофизиологията на цьолиакия с нейните хистопатологични корелати. Системата за класификация на Марш очертава четири категории лезии, свързани с глутенова ентеропатия:
- прединфилтративна (тип 0)
- инфилтративна (тип 1)
- инфилтративно-хиперпластична (тип 2)
- плоскодеструктивна (тип 3)
Атрофично-хипопластичната (тип 4) лезия се появява в по-късните публикации. Тази система оценява наличието на имунен отговор в епитела и описва степента на архитектурни промени в лигавицата. Тази класификация е ревизирана, за да се улеснят диагностичните приложения, като система за класифициране Marsh–Oberhuber, които подкатегоризират лезии от тип 3 въз основа на височина на вилите като тип 3a-лека атрофия, тип 3б-с атрофия и 3c-обща атрофия на вили. Тази класификация е широко използвана от патолозите днес.
Тип 0 лезия съдържа хистологично нормална лигавица на тънките черва. Вилозната архитектура е неподправена от закърняване на вили или хиперплазия на криптата. Пациентите от тази група могат да бъдат идентифицирани само въз основа на серологични критерии и могат да останат клинично мълчаливи.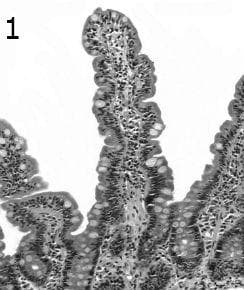
Тип 1 лезиите се характеризират с архитектурно нормална лигавица на тънките черва и съдържат интраепителиална лимфоцитоза. При липса на клинична или фамилна анамнеза или серологично доказателство за заболяване цьолиакия, това наблюдение предполага, но не е диагностично. Повишените интраепителиални лимфоцити с иначе необичайна вилозна архитектура могат да се появят при до 10%, първоначално представящи цьолиакия (фигура 1).
Архитектурно, инфилтративно-хиперпластичната лезия поддържа нормална архитектура, но съдържат хиперплазия на криптите. Това е съчетано с интраепителиална лимфоцитоза - повече от 30 интраепителиални лимфоцити на 100 епителни клетки. Рядко наблюдавана в клинична обстановка, ползата от тази категория е наскоро оспорвана. Както при лезии от тип 1, наличието на само лезия от тип 2 е достатъчно неспецифично, за да не предизвика незабавно диагнозата на цьолиакия. Клинично може да се наблюдава, например, при пациенти с глутенова ентеропатия, които са подложени на лечение, или при херпетиформен дерматит.
Лезиите от тип 3 се характеризират с увеличен брой интраепителиални лимфоцити, криптова хиперплазия и вилозна атрофия. 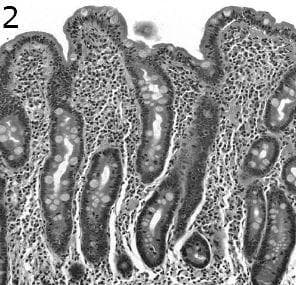 Лезиите от тип 3 могат да бъдат категоризирани на базата на вилозна атрофия на тип 3a (лек), с незначителна атрофия, тип 3b (умерено), с междинна атрофия (фигура 2) и тип 3c, с плоска лигавица и без видими вили. Недобре ориентираните образци могат да доведат до невъзможност да се оценят фините различия във височината на вилите. Това може да бъде особено проблематично при разграничаването на лезии от тип 3а и 3b.
Лезиите от тип 3 могат да бъдат категоризирани на базата на вилозна атрофия на тип 3a (лек), с незначителна атрофия, тип 3b (умерено), с междинна атрофия (фигура 2) и тип 3c, с плоска лигавица и без видими вили. Недобре ориентираните образци могат да доведат до невъзможност да се оценят фините различия във височината на вилите. Това може да бъде особено проблематично при разграничаването на лезии от тип 3а и 3b.
Тип 4 лезиите нямат вили, но съдържат нормална височина на криптата и нормален брой на интраепителиални лимфоцити. Съобщава се, че са необратими и се смята, че са резултат от недохранване или като последица от анормална интраепителиална лимфоцитна хомеостаза.
Библиография
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1861744/
https://www.aafp.org/afp/2002/1215/p2259.html
https://www.nps.org.au/australian-prescriber/articles/gluten-enteropathy
https://emedicine.medscape.com/article/171805-workup#c6
https://en.wikipedia.org/wiki/Coeliac_disease
Коментари към Глутенова ентеропатия