Химически карциногени

Използването на химически съединения е от полза за обществото по много начини. Пестицидите например позволяват произвеждането на храни в достатъчни количества, за да задоволят нуждите на милиони хора, което е довело до увеличаване на нивата на продължителност на живота. От време на време обаче, тези ползи се компенсират от някои недостатъци, особено от токсичните странични ефекти на използваните химични съединения. Излагането на тези съединения може да има различни ефекти, вариращи от моментална смърт до постепенен процес на химична карциногенеза.
Епигенетичните фактори, които също се считат за негенетични по характер, също могат да допринесат за карциногенеза чрез епигенетични механизми. Контролът на отговорите на канцерогенезата чрез прилагането на няколко химични, биохимични и биологични техники улеснява идентифицирането на тези основни механизми, участващи в неоплазменото развитие. Експерименталните тестове с лабораторни животни, епидемиологичните изследвания и бързите тестове позволяват идентифицирането на канцерогенните съединения, дисекцията на много аспекти на карциногенезата и създаването на ефективни стратегии за предотвратяване на рака, който се получава при излагане на химически карциногени.
Химическата карциногенеза е многостепенен процес, при който нормалните клетки стават първо инициирани, след това злокачествени и инвазивни. Всеки от тези етапи е изключително сложен сам по себе си. Много химикали са канцерогенни чрез метаболитно биоактивиране и упражняват генотоксична активност на нивото на генома. Тази основна дейност обаче е само един фактор в последователност от сложни събития.
Класификацията на канцерогенните съединения според техния механизъм на действие продължава да предизвиква противоречия. Болт предлага разделянето на генотоксичните съединения на две групи: тези, които реагират с ДНК и генотоксични на хромозомно ниво. Съединенията, които взаимодействат с ДНК, се подразделят на три различни групи:
- инициатори (с неограничени дози)
- гранични
- слаби генотоксични (действат чрез вторични механизми)
Химичните канцерогени могат да имат допълнителни синергични или антагонистични ефекти, когато се представят едновременно по различни метаболитни начини. Химичните канцерогени могат да бъдат класифицирани в няколко групи (Фигура 1).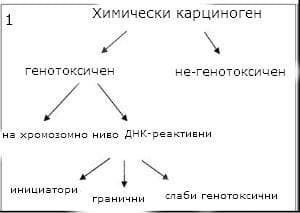
След експозицията химически канцерогени могат да бъдат абсорбирани по няколко начина (перорално, инхалаторен, кожен и инжекционен) и разпределени в няколко тъкани. Абсорбцията зависи от физикохимичните свойства на веществото и може да се осъществи чрез пасивен или активен транспорт. Веществата, абсорбирани през устата, преминават през черния дроб и едва тогава се разпределят в тялото. Тези, абсорбирани в белия дроб, се разпределят в кръвта, преди да достигнат черен дроб на по-късен етап. Тези канцерогенни съединения, класифицирани като директни, действат директно върху ДНК, но повечето изискват ензимно превръщане и по този начин са обозначени като непряк или прокарциногени. Метаболичното активиране се контролира от реакции от фаза I, докато реакциите от фаза II защитават тялото чрез трансформиране на активираните съединения в инертни продукти, които лесно се елиминират от тялото.
Ефективността на метаболитните ензими е от съществено значение за разбирането на химическата карциногенеза и изучаването на различията между видовете, доколкото те са чувствителни към развитието на неоплазмата. Ензимите във фаза I участват в реакциите на окисление, редукция и хидролиза и се класифицират като оксидоредуктази (монооксигенази зависими от цитохром Р450, флавин монооксигенази, циклооксигенази и алкохолдехидрогеназа) и хидролази (епоксидни хидролази). Ензимите от фаза II участват в конюгацията и инактивирането на химични канцерогени и включват трансферази (глутатион S-трансферази, N- ацетилтрансферази, UDP-глюкуронозилтрансферази, сулфотрансферази). Въпреки че първоначално се счита, че тези ензими участват в етапите на детоксикация на биотрансформацията, те също могат да допринесат за активирането на някои прокарциногени in vivo.
Метаболичното активиране се проявява предимно в черния дроб в обикновения ендоплазмен ретикулум, където цитохром Р450 е по- богат и в по-малка степен в пикочния мехур, кожата, стомашно-чревната система, хранопровода, бъбреците и белите дробове. По време на тази фаза цитохром Р450 моно-оксигеназите въвежда реактивна полярна група в канцерогенната, което я прави липофилен. След това той го превръща в мощен електрофилен продукт, способен да установи адукти с ДНК. Реакциите от фаза ІІ се катализират от чернодробни и допълнителни чернодробни, цитоплазмени и цитохромни ензими, действащи отделно или заедно. Реакциите на конюгиране позволяват на тези ензими да разграждат полярната група в глюкоза, аминокиселини, глутатион и сулфат, които са по-малко токсични метаболити, които са по-разтворими във вода и по-лесно изхвърлени от урината и жлъчката.
Има три етапа на химическа карциногенеза: иницииране, промоция и прогресия. Всеки от тези етапи се характеризира с морфологични и биохимични модификации и е резултат от генетични и/или епигенетични промени. Тези генетични модификации включват: мутации в гени, които контролират клетъчната пролиферация, клетъчна смърт и възстановяване на ДНК - тоест мутации в прото-онкогени и туморни гени.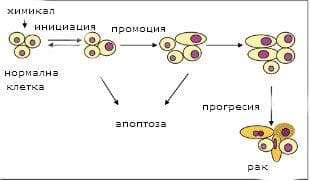
Инициирането е бързо, необратимо явление и се предава на дъщерните клетки. Инициирането е процес на добавяне, неопластичното развитие зависи от канцерогенната доза, увеличаването на дозата увеличава честотата и множествеността на произтичащите неоплазии и намалява латентния период на неговото проявление. Химикалите, които инициират карциногенезата, са изключително разнообразни по структура и включват както естествени, така и синтетични продукти. Те са:
- директно действащи съединения, които не изискват химическа трансформация
- съединения с непряко действие или прокарциногени, които изискват метаболитно превръщане, за да се получат крайни канцерогени
ДНК щетите са добре установени като събитие, което стартира химическа канцерогенеза. Клетките, които пролиферират, имат по- малко време да поправят увредената ДНК и да премахнат ковалентните връзки, които химикалите създават с ДНК - известни като адукти. Този процес на иницииране гарантира, че клетъчното деление остава симетрично, като създава две нови инициирани клетки. Клоналното разширяване на инициираните клетки е резултат от митогенен процес, причинен от увеличаване на броя на нови клетки и инхибиране на апоптозата, което предотвратява умирането на инициираните клетки. Инициирането включва нелетална и наследствена мутация в клетките чрез взаимодействие на химикал с ДНК. Активирането на канцероген в електрофилна ДНК-увреждаща част е необходима стъпка за този етап. Предполага се, че реактивните кислородни радикали медиират активирането на такива канцерогени чрез хидропероксидно зависимо окисление, което може да бъде медиирано от пероксилни радикали. Това се случва с афлатоксин В, ароматни амини и полициклични ароматни въглеводородни дихидродиоли. Реактивните кислородни радикали или техният страничен продукт на липидна пероксидация, могат също директно да реагират с ДНК, за да образуват окислителни ДНК адукти.
След като започналата клетка бъде насърчена да се възпроизведе, инициираните генетични увреждания са необратимо фиксирани. Когато инициираната клетка е подложена на етапа промоция, ефектът е да се насърчи клоновото разширение на инициираната клетка. Ключова характеристика на реакцията на промоцията е нейната обратимост, тоест ако промотиращият агент бъде отстранен, инициираната клетъчна популация вече не се насърчава да се размножава. Процесът на промотиране включва епигенетични процеси, отговорни за образуването на злокачествения фенотип и оцеляването на туморни клетки. Канцерогенността на някои химически карциногени се увеличава чрез последващо прилагане на промотори (като форбол естери, хормони, феноли и лекарства), които сами по себе си не са туморогенни. Прилагането на промотори води до пролиферация и клонова експанзия на инициирани (мутирали) клетки. Организаторите на промотора не взаимодействат директно с ДНК и не предизвикват биологични ефекти, без да бъдат метаболитно активирани. Тези средства повишават клетъчната пролиферация в чувствителни тъкани, допринасят за фиксиране на мутации, подобряват измененията в генетичната експресия и причиняват промени в контрола на клетъчния растеж. Промоторите могат индиректно да увреждат ДНК чрез окисляване. Патологично това води до образуване на пренеопластична лезия (от стартовата клетка). Генерирането на реактивни кислородни радикали е свързано с ензимната активност на P450, а оксидативният стрес може да има важна роля при клоновата експанзия на инициираните клетки.
Тъй като инициираната клетъчна популация се разширява по време на промоцията, отделните клетки придобиват по-нататъшно генетично увреждане, което може да бъде или средство, медиирано, или спонтанно, като по този начин въвежда генетична хетерогенност в популяризираната популация. Придобиването на тези промени е необратимо и прогресивно. Прогресията се състои в производството и подбора на клетъчни клонове, способни да се конкурират благоприятно с нормалната клетъчна среда. В прогресията се придобива неопластичен фенотип чрез генетични и епигенетични механизми. По време на прогресията, клетъчната пролиферация е независима от наличието на стимул. Характеризира се с необратимост, генетична нестабилност, по-бърз растеж, инвазия, метастазиране и промени в биохимичните, метаболитните и морфологичните характеристики на клетките.
Библиография
Color atlas of pathology, Section Tumor pathology
https://www.sciencedirect.com/topics/neuroscience/carcinogens
https://yourhealthofima.wordpress.com/2012/09/08/chemical-carcinogenesis-a-brief-review/
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0001-37652007000400004
https://www.britannica.com/science/carcinogen
Коментари към Химически карциногени