Натрупване на амилоид
Амилоидът е хетерогенен белтък, който показва постоянни и характерни морфологични и оцветителни свойства. Амилоидът се дефинира като in vivo отложен материал, отличаващ се съд следното:
- фибриларен външен вид върху електронната микрография
- аморфен еозинофилен външен вид върху оцветяване с хематоксилин и еозин
- бета-нагъната листова структура, наблюдавана чрез рентгенов дифракционен образец
- ябълковозелено брефрингенция върху конго-червено хистологично оцветяване
- разтворимост във вода и буфери с ниска йонна сила
Всички видове амилоид се състоят от един основен фибриларен протеин, който определя вида на амилоида. Полиморфизми, които леко променят естествените пептиди или възпалителни процеси, определят етапа на анормално натрупване на белтъци и отлагане на амилоидни фибрили. Много от класическите епиномични заболявания по-късно са свързани с разнообразни масиви от неправилно нагънати полипептиди (амилоид), които съдържат общата архитектура на бета-плетени листове.
Кватернерната протеинова структура обикновено се ражда от единична транслирана протеинова последователност с една подредена конформация с низходящи протеинови взаимодействия. Въпреки това амилоидните фибрили могат да имат различни протофиламентни числа, аранжименти и полипептидни конформации. Също така е важно да се разбере, че една и съща полипептидна последователност може да произведе много различни модели на взаимодействащи помежду си структури.
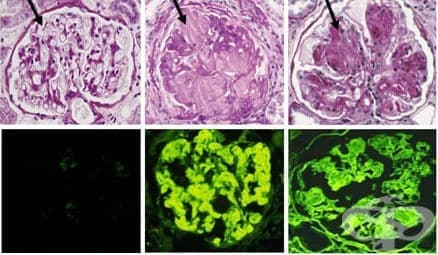
Амилоидозата е клинично нарушение, причинено от извънклетъчно и/или вътреклетъчно отлагане на неразтворими анонимни амилоидни фибрили, които променят нормалната функция на тъканите. Само 10% от амилоидозните отлагания се състоят от компоненти като гликозаминогликани, аполипопротеин-Е и серумен амилоиден Р-компонент, докато почти 90% от отлаганията се състоят от амилоидни фибрили, на неправилно нагънати протеини. Тези протеини произтичат или от протеини, експресирани от клетките в мястото на отлагане (локализирани), или се утаяват системно след производство в локално място (системно). При хората около 23 различни несвързани протеини е известно, че образуват амилоидни фибрили in vivo.
Много механизми на протеиновата функция допринасят за амилоидогенезата, включително нефизиологична протеолиза, дефектна или отсъстваща физиологична протеолиза, мутации, включващи промени в термодинамичните или кинетичните свойства и пътища, които все още предстои да бъдат дефинирани.
Натрупването на амилоид в интерстициума на различни органи при различни заболявания се нарича амилоидоза. Химическият анализ на амилоидните фибрили показва, че той е съставен от различни полипептиди, което определя и формирането на различни видове амилоид. Те се образуват при условията на различни морфогенетични механизми. Известни са две главни и няколко допълнителни химични форми на амилоид: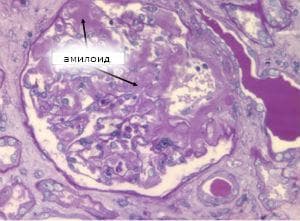
- AL - амилоид - съставен е от цели леки вериги на имуноглобулини или техни фрагменти. Този амилоид се синтезира при имуноцитни дискразии.
- AA - амилоид - съставен е от неимуноглобулинови фибрилерни протеини. Тези протеини произхождат от прекурсурен протеин на кръвния серум - SAA /серумен амилоидо - свързан протеин/. Той представлява апопротеин в състава на високо плътностните липопротеини. Синтезира се в черния дроб и се открива в незначителни количества в серума на здрави хора. При възпалителен стимул, обаче, количеството му в кръвта нараства бързо стотици пъти.
При различните видове амилоидоза в амилоидните депа са идентифицирани и други протеини:
- Транстиретин - представлява нормален серумен протеин, който транспортира тироксин и ретинол. При група генетично детерминирани. Заболявания, означени като фамилна амилоидна полиневропатия се откриват абнормени мутантни форми на транстиретин и негови фрагменти, които са главната структурна съставка на амилоида. Транстиретинът се отлага и при старческата кардиачна амилоидоза.
- b2 - амилоиден протеин /наричан А4/ - отлага се в мозъчните плаки и стените на мозъчните кръвоносни съдове при болестта на Алцхаймер.
Във всички форми на амилоидоза, клетката секретира прекурсорния протеин в разтворима форма, която става неразтворима в някои тъкани, като компрометира органната функция. Всички амилоидни прекурсорни протеини са относително малки и не споделят никаква хомоложност на аминокиселинната последователност. Вторичните протеинови структури на най-разтворимите прекурсорни протеини имат значителна бета-напластена листова структура, докато обширна бета-листова структура се получава във всички депозирани фибрили.
В някои случаи съществуват наследствени аномалии (предимно точкови мутации или полиморфизми) в прекурсорните протеини. В други случаи, фибрилите се образуват от молекули с нормална последователност (напр. AL, β2М). В други случаи протеините с нормална последователност могат да образуват амилоид, но мутациите, които стоят в основата на възпалителната среда, ускоряват процеса.
При локализирани амилоидози депозитите се намират близо до мястото на синтеза на прекурсора. Обаче, при системни амилоидози депозитите могат да се образуват локално или на разстояние от клетките, произвеждащи прекурсори. Амилоидните отлагания са предимно извънклетъчни, но съществуват съобщения за фибриларни структури в макрофагите и плазмените клетки.
При някои видове амилоидоза амилоидните прекурсори се подлагат на протеолиза, което може да засили сгъването в амилоидогенен структурен междинен продукт. В допълнение, някои от амилоидозите могат да имат нормален протеолитичен процес, който е нарушен, което води до висока концентрация на амилоидогенен междинен продукт. Например, доказано е, че мастоцитите на алергични реакции могат също да участват в развитието на вторични или възпалителни амилоидози при хронични възпалителни състояния. Мастните клетки ускоряват частичното разграждане на серумен амилоидо - свързан протеина, който може да продуцира силно амилоидогенни N-крайни фрагменти на серумен амилоидо - свързан протеин. Факторите, които водят до различни органни тропизми за различните амилоидози обаче все още са до голяма степен неизвестни.
Дали протеолизата се появява преди или след отлагане на тъкани не е ясна при пациенти, при които се наблюдават бета-протеинови фрагменти в тъканните отлагания. При някои типове амилоиди нефибриларни форми на същите молекули могат да се натрупват преди образуването на фибрил. По този начин нефибриларните отлагания в някои случаи могат да представляват междинно отлагане.
Макроскопски органите с масивни амилоидни натрупвания са уголемени по размери, бледи, с восъчна плътност. Срезната им повърхност е сивкава, хомогенна и блестяща. При минимални амилоидни отлагания макроскопската диагностика е невъзможна до използването на оцветяване с луголов разтвор и сярна киселина:
- луголов разтвор - амилоидът се оцветява червено-кафяво
- при прибавяне на 10% сярна киселина, цветът му става виолетов
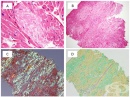
Микроскопската характеристика се определя от локализацията на амилоида в определени структури на дадени органи. Амилоидът се разполага извънклетъчно като хомогенно, без клетъчно вещество. Диагностиката се осъществява с помощта на следните оцветителни методи: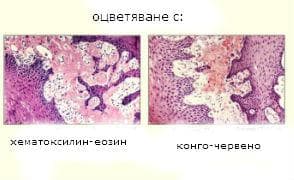
- хематоксилин и еозин - амилоидът се оцветява розово
- метил-виолет - амилоидът показва метахромазия /розово-червено оцветяване, а околните тъкани се багрят виолетово/
- крезил-виолет - метахромазия / розово-червено оцветяване на амилоида, а околните тъкани се багрят виолетово/
- конгорот - амилоидът се багри оранжево-червено. При изследване с поляризационен микроскоп, оцветеният с конгорот амилоид свети в зелено.
- калиев перманганат - силно намалява конгофилията на АА - амилоида, а тази на АL-амилоида не се променя. По този начин разграничаването на двата главни типа амилоид може да се извърши и на хистологичен срез.
- тиофлавин S - при флуоресцентна микроскопия, свързаният с флуорохроматиофлавин S амилоид флуоресцира в жълто-зелено.
Библиография
Color atlas of pathology, Section Connective tissue lesions
http://emedicine.medscape.com/article/335414-overview#a1
https://en.wikipedia.org/wiki/Amyloidosis
https://rarediseases.org/rare-diseases/amyloidosis/
http://www.amyloidosis.org.uk/diagnosis/biopsy/
СТАТИЯТА е свързана към
- Обща патология
- Патология на съединителната тъкан
- Хранене при амилоидоза
- Локализирана амилоидоза
- Амилоидозата – един от факторите за развитие на болестите на Алцхаймер и Паркинсон
- Програма открива двойки амилоидни протеини с точност до 94%
- Кожната биопсия улеснява поставянето на диагноза транстиретинова амилоидоза
- Генерализирани системни амилоидози
Коментари към Натрупване на амилоид