Аденокарцином на хранопровода
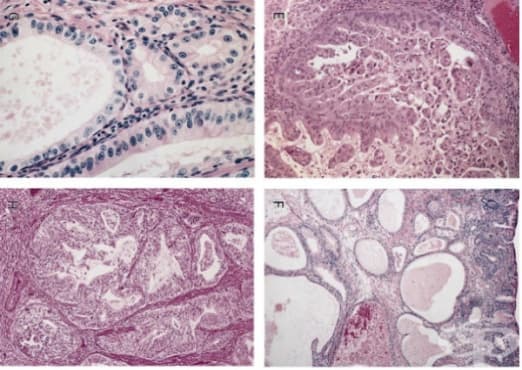
Аденокарциномите се считат за най-бързо развиваща се неоплазия в западните страни. Обикновено засяга долната част на хранопровода, може да бъде предшестван от Баретов езофаг, усложнение от гастроезофагеална рефлуксна болест.
Епидемиологията на аденокарцином на хранопровода се променя. Преди средата на 70-те години на миналия век, честотата му изглежда е представлявала по-малко от 5% от всички ракови заболявания на хранопровода. След това честотата се е увеличила бързо в Съединените щати и в големи части на Европа.
Сега е ясно, че повечето аденокарциноми се развиват от Баретов езофаг. В литературата са описани много рискови фактори за развитието на тези заболявания. Гастроезофагеалната рефлуксна болест е най-важният фактор за развитието на баретов езофаг и последващия аденокарцином. Клинично, баретовия езофаг се появява при редица състояния, които могат да причинят гастроезофагеален рефлукс, като ахалазия, склеродермия, активна дуоденална язва, предишна стомашна операция, болест на Crohn и други.
Възрастовото разпределение е подобно на повечето други стомашно-чревни ракови заболявания, с повишен риск с нарастване на възрастта. Средната възраст на диагнозата е около 60 години. Една необяснима характеристика на честотата на езофагеалния аденокарцином е поразителното мъжко преобладаване (7:1). Това наблюдение е сходно във всички проучени популации. Въпреки че силното преобладаване на мъжете предполага роля на половите хормони в етиологията, антиандрогенното лечение при пациенти с рак на простатата не намалява значително риска от аденокарцином.
Други рискови фактори включват висок прием на червено месо и полинаситени мазнини, по-ниска консумация на плодове, зеленчуци, риба, витамини А, С и Е, β-каротин и сурови влакна, високо съдържание на желязо, затлъстяване, пушенето на цигари и консумацията на алкохол, някои медикаменти, отпускащи долния езофагеален сфинктер (като блокери на калциевите канали, теофилин и β-агонисти) и имуносупресивен статус. Инфекцията с Helicobacter pylori е била предложена преди като рисков фактор. Последните проучвания обаче показват защитен ефект на някоищамове на H.pylori срещу аденокарцином.
Повечето езофагеални аденокарциноми възникват в дисталния хранопровод. Не често може да възникне по-проксимално в хетеротропната стомашна лигавица. Изглежда, че развитието им се проявява чрез прогресивно натрупване на множество генетични аномалии като мутационно инактивиране на p16, и p53 гени, аномалии на клетъчния цикъл и анеуплоидия. Молекулярният механизъм е сложен и не може да бъде приписан на едно генетично събитие.
Счита се, че последователността от събития, водещи до аденокарцином на хранопровода от гастроезофагеална рефлуксна болест, включва развитието на възпалително стимулирана хиперплазия и метаплазия, последвани от мултифокална дисплазия, карцином in situ и накрая инвазивен аденокарцином. Физиологичен гастроезофагеален рефлукс се появява при нормални хора и не произвежда нито симптоми, нито хистологични промени в хранопровода. Само когато гастроезофагеалният рефлукс е чест и тежък, той може да предизвика симптоми или усложнения. Дуоденогастралният рефлукс също е често срещано явление.
Тъй като сквамозният епител е по-уязвим към рефлуксата от колонния епител, заместването с колонен епител повече или по-малко облекчава симптомите на гастроезофагеален рефлукс. Най-предпочитаната хипотеза за произхода на баретов езофаг е метаплазия на плурипотентни стволови клетки в базовия клетъчен слой при многократно стимулиране от рефлуксата. Предложени са най-малко два други възможни източника:
- пълзящо заместване на колонни клетки от стомашната кардия
- размножаване на колониалните клетки от канала на езофагеалната жлеза, както е наблюдавано при хора и експериментални животински модели
Въпреки че хипотезата за метаплазия е предпочитана, тя не изключва други възможности. Най-важният междинен маркер за злокачествен потенциал е тежката дисплазия.
Хистологично, това са жлезо-образуващи тумори с тубуларен, тубулопапиларен или папиларен модел на растеж. Малка част от случаите показва муцинова диференциация. Туморите показват променливи степени на диференциация въз основа на количеството образуване на жлези, а ядрената атипия обикновено следва степента на диференциация. Добре диференцираните тумори показват повече от 95% образуване на жлези, умерено диференцираните тумори показват 50-95%, а слабо диференцираните тумори - по-малко от 50%.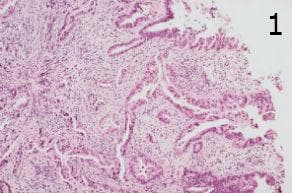
Аденокарциномите, които възникват от лигавицата на баретов езофаг, обикновено са добре или умерено диференцирани и имат добре оформени тубуларни или папиларни структури, фигура 1. При слабо диференцирани аденокарциноми, жлезистите структури са образувани сложно. При недиференцирани аденокарциноми липсват жлезисти структури.
Редки тумори могат да бъдат бифенотипни, както с плоскоклетъчна, така и с муцинозна/жлезиста диференциация. Туморите с интимна смес от плоскоклетъчен и муцинозен елемент се обозначават като мукоепидермоиден карцином. Туморите, съставени от два отделни плоскоклетъчни и муцинозни елемента, съседни един на друг, се наричат като аденосквамозен карцином.
Диференциалната диагноза на аденокарцином на хранопровода включва метастази или директно разпространение от тумори на белия дроб или гърдата. Морфологично те имитират първичен аденокарцином на хранопровода. Имунохистохимичното оцветяване е полезно за диференциране. За разлика от първичния аденокарцином на хранопровода, аденокарциномът на белия дроб е положителен при имунооцветяване за тироиден транскрипционен фактор 1 (TTF-1), а аденокарцинома на гърдата е положителен за имунооцветители за естрогенен рецептор и GATA 3.
Библиография
https://academic.oup.com/carcin/article/22/8/1119/2608106
https://www.amboss.com/us/knowledge/Esophageal_cancer
https://gut.bmj.com/content/54/suppl_1/i1#block-system-main
https://emedicine.medscape.com/article/277930-workup#c5
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5387146/
Коментари към Аденокарцином на хранопровода