Клетъчно увреждане от химически фактори
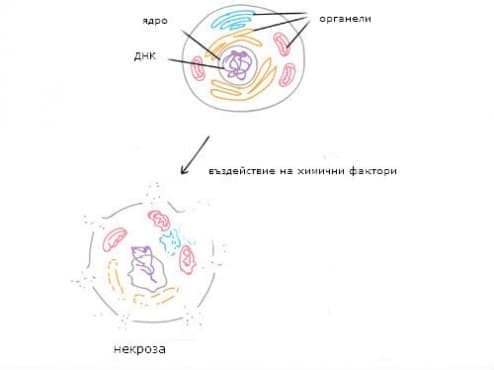
Клетъчното увреждане може да възникне в резултат на неблагоприятен стимул, който нарушава нормалната хомеостаза на засегнатите клетки. Сред другите причини това може да се дължи на физически, химически, инфекциозни, биологични, хранителни или имунологични фактори. Повлияването на клетките може да бъде обратимо или необратимо. В зависимост от степента на клетъчно увреждане от химически фактори, клетъчният отговор може да бъде адаптивен и, където е възможно, да се възстанови хомеостазата. Клетъчната смърт се случва, когато тежестта на нараняването надвишава способността на клетката да се ремонтира. Клетъчната смърт е относителна както към продължителността на излагане на вредни стимули, така и към сериозността на причинените увреждания.
Химическите фактори, които могат да увредят клетката се разделят по вид и по механизъм на увреждане на две големи групи:
- Лекарствени фактори
- Не лекарствени фактори
Някои химикали, а именно каустични агенти и минерални киселини са в състояние да увреждат тъканите директно, други като тежки метали и отрови главно нарушават важни ензимни реакции. Метаболитната хомеостаза на клетките и тъканите също е нарушена от действието на генотоксични и протеотоксични средства. Често срещаните дефекти са: разрушаване на клетъчните мембрани, намаляване на вътреклетъчното рН, освобождаване на лизозомни ензими и промени, подобни на тези при хипоксия (намаляване на окислителното фосфорилиране). Лизозомните ензими и свободните радикали, получени от кислорода (реактивни кислородни междинни продукти) или от азота (реактивни азотни междинни съединения) имат съществена роля в увреждането на клетъчните структури, особено по време на увреждащото възпаление. Тези вещества могат да се активират и чрез действието на много амфифилни детергенти, които са компоненти на различни почистващи и миещи препарати и пасти за зъби. Те са опасни, ако достигнат вътре в тялото в неподходяща сума или по неподходящ начин.
Дефицитът на кислород се проявява в рамките на 3-5 минути. В митохондриите оксидативното фосфорилиране бързо се нарушава и се появява недостатъчно производство на аденозинтрифосфат (АТФ). Дефицитът на АТФ активира анаеробния метаболизъм, при който АТФ се образува от гликоген. Но резервите от гликоген отново се изчерпват. Поради продължителната недостатъчност на АТФ, натриево-калиевата помпа губи оперативния си капацитет. Това води до вътреклетъчно натрупване на натрий и изтичане на калий от клетките. Натрупването на натрий предизвиква прехвърлянето на йони и вода в клетката. Това е причината за дилатацията на ендоплазмения ретикулум. Дилатацията осигурява пълно увреждане на рибозомите и блокира протеосинтезата.
Ако хипоксията продължава, цялата клетка е препълнена с вода, натрий и хлориди. Това състояние е все още обратимо, след подновяване на транспорта на кислорода клетката трябва да се възстанови. В други случаи се появяват вакуоли в цитоплазмата и увреждането на митохондриалната мембрана. Сега това е необратимият процес. Поради увреждането на мембраната, извънклетъчният калций може да навлезе в клетката и да се натрупа в митохондриите. Производството на АТФ е напълно прекратено, което се смята за истинската смърт на клетката. Смъртта на клетките или тъканите се извършва като некроза.
Клетъчните увреждания могат да бъдат причинени и от различни газове, особено от азотни оксиди, серен диоксид, въглероден оксид, формалдехид, хлор и други. Въглеродният монооксид се свързва с хемоглобин с 300 пъти по-висок афинитет от кислорода. Поради това експозицията на въглероден оксид развива вторичния недостиг на кислород, дължащ се на прекратяването на транспорта на кислород в клетките.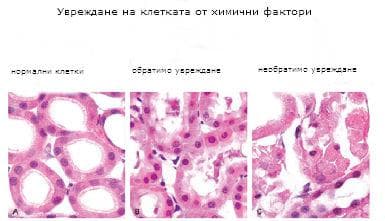
Механизмът на действие на химическите фактори може да бъде:
- Директен - това е такъв химичен фактор е живакът от живачния хлорид, свързващ се със SH групи на мембранните протеини на клетката. Той причинява увеличение пермеабилитета на мембраните и инхибира АТФ - ния транспорт.
- Индиректен - най-често това става чрез преобразуване на реактивните токсични метаболитни продукти в реактивни свободни радикали.
Видовете клетъчно увреждане от химически фактори могат да се илюстрират с няколко примера:
- Флуорацетатно отравяне - тази субстанция блокира цикъла на Кребс - летална синтеза.
- Тетрахлорметан /CCI4/ - той се използва широко в експерименталната патология. Инжектиран в опитното животно, той се трансформира в трихлорметан в гладкия ендоплазматичен ретикулум на хепатоцитите. Трихлорметанът предизвиква липидна пероксидация и автокаталитична реакция, която води до набъбване и разпад на ендоплазматичния ретикулум, откъсване на рибозомите от гранулирания ендоплазматичен ретикулум и потискане на протеиновата синтеза в хепатоцита. Загубата на липидни акцептори за протеина се последва от натрупване на липиди и мастна дегенерация на черния дроб. Ако продължи действието на трихлорметана, клетъчното увреждане се задълбочава. Започва разграждане на клетъчните мембрани, което завършва със смърт на клетката.
- Дифтериен токсин - този токсин предизвиква инхибиция на белтъчната синтеза.
- Актиномицин D - инхибира транскрипцията на ДНК в РНК.
- Холерен токсин - уврежда натриевата помпа на тънкочревните епителни клетки, след което настъпва остро оводняване и набъбване на тези клетки.
Някои химически фактори имат селективно увреждащо действие. Например, алоксанът е токсичен само за Лангерхансовите островчета на панкреаса.
Библиография
Color atlas of pathology, Section Cellular pathology
http://www.patfyz.sk/ZapalWEB/node7.html
http://www.newagemedical.org/celldeath-injury-link2.pdf
https://en.wikipedia.org/wiki/Cell_damage
Коментари към Клетъчно увреждане от химически фактори