Злокачествена хипертермия, дължаща се на анестезия МКБ T88.3

Злокачествената хипертермия е рядко, но животозастрашаващо, автозомно-доминиращо наследствено заболяване, което може да доведе до метаболитна криза на скелетните мускули при чувствителни индивиди след излагане на отключващи агенти, като летливи анестетици или деполяризиращи мускулни релаксанти.
Злокачествената хипертермия е фармакогенетично разстройство, което се проявява като хиперметаболитен отговор на мощни инхалационни агенти (като халотан, изофлуран, севофлуран, десфлуран), деполяризиращия мускулен релаксант сукцинилхолин и рядко при хора, на стресори като енергични упражнения и топлина.
Анестетиците са противоречиви при задействането на злокачествената хипертермия. Възприемчив индивид може да претърпи анестезия с малигнена хипертермия-задействащи агенти на няколко пъти без инциденти, но все пак може да реагира на такива агенти в следващ случай. Всъщност има съобщения за епизоди, които се случват дори при използване на предполагаемо безопасни агенти.
Епидемиология
Честотата на злокачествена хипертермия, дължаща се на анестезия е между 1:10 000 и 1:250 000 анестетици. Въпреки малигнения епизод може да се развие при първото излагане на анестезия с тези агенти, за които е известно, че предизвикват малигнена хипертермия, средно пациентите се нуждаят от три анестетика преди задействане. Реакциите се развиват по-често при мъжете, отколкото при жените (2:1). Засегнати са всички етнически групи във всички части на света. Най-високата честота е при млади хора, със средна възраст на всички пациенти, изпитващи реакции от 18,3 години. Установено е, че децата под 15-годишна възраст представляват 52,1% от всички реакции. Въпреки че е описана при новороденото, най-ранната реакция, потвърдена от теста, е на шестмесечна възраст. Най-възрастният пациент е на 78 години.
Очакваното разпространение на генетични аномалии, свързани с чувствителността към злокачествена хипертермия, може да бъде толкова голямо, колкото един на 3000 индивида (диапазон 1:3000 до 1:8500), като по-скорошната оценка е 1 на 400.
Мауриц и сътрудници установяват честота от 1:37 500 при пациенти, които са били диагностично тествани, което е подобно на честотата, изчислена от Robinson, въпреки че е отчетена широка вариабилност. Неотдавнашен доклад предполага, че податливост към злокачествена хипертермия може да присъства в 1:2000–3000 от френското население. Подобна честота е докладвана за японското население. Bachand и колеги проследяват родословията на пациентите със злокачествена хипертермия в Квебек, Канада до първоначалните имигранти от Франция и откриват честота на податливост на злокачествена хипертермия от 0,2% в тази провинция. Това обаче представляваше само пет разширени семейства. По същия начин 1/200 пациенти, представящи се за анестезия в района на Manawatu в Нова Зеландия, са податливи злокачествена хипертермия.
Етиология
Злокачествената хипертермия е нарушение, което може да се счита за взаимодействие между ген и среда. При повечето хора със склонност към злокачествена хипертермия те имат малко или никакви симптоми, освен ако не са изложени на отключващ агент. Най-честите отключващи агенти са летливи анестетични газове, като халотан, севофлуран, десфлуран, изофлуран, енфлуран или деполяризиращите мускулни релаксанти суксаметоний и декаметоний, използвани предимно в обща анестезия. В редки случаи биологичният стрес от физически упражнения или топлина може да бъде отключващ фактор.
Други анестетични лекарства не предизвикват злокачествена хипертермия. Някои примери за лекарства, които не причиняват злокачествена хипертермия, включват местни анестетици (лидокаин, бупивакаин, мепивакаин), опиати (морфин, фентанил), кетамин, барбитурати, азотен оксид, пропофол, етомидат и бензодиазепини. Недеполяризиращите мускулни релаксанти панкуроний, цизатракурий, атракурий, мивакурий, векуроний и рокурониум също не причиняват злокачествена хипертермия.
Има все повече доказателства, че някои индивиди със склонност към злокачествена хипертермия могат да я развият при тежки физически упражнения и/или при излагане на гореща среда.
Генетика
Наследяването на злокачествената хипертермия е автозомно доминиращо с променлива проникване. Дефектът обикновено се намира на дългото рамо на хромозома 19, включващо рианодиновия рецептор. Повече от 25 различни мутации в този ген са свързани със злокачествена хипертермия. Тези мутации са склонни да се групират в един от трите домена в протеина, обозначен като MH1-3. MH1 и MH2 са разположени в N-края на протеина, който взаимодейства с L-тип калциеви канали. Протеина MH3 се намира в трансмембранния образуващ С-край. Този регион е важен за разрешаване на преминаване на калциевите йони през протеина след отваряне.
Хромозома 7q и хромозома 17 също са замесени. Предполага се също, че злокачествена хипертермия и централното ядро могат да бъдат алелни и по този начин могат да бъдат наследявани съвместно.
Патофизиология
Физиологичното свиване на скелетната мускулатура възниква чрез освобождаването на калциеви йони (Ca2+) от системата за съхранение на клетката - саркоплазмен ретикулум. За да се задейства мускулна контракция, електрически импулс (потенциал за действие) от двигателния нерв се прехвърля към мускулната клетка. Това води до активиране на контролиран с напрежение йонен канал в издатини в клетъчната мембрана (Т-каналчета). Това е в пространствен контакт с калциев канал на саркоплазматичния ретикулум, рианодиновият рецептор, който впоследствие се отваря. Калцият (Ca2+), попадащ във вътрешността на клетката (цитозол), позволява на актиновите и миозиновите нишки да се свиват и мускулите да се свиват. Тази връзка между потенциала за действие и мускулната контракция се нарича електромеханично свързване.
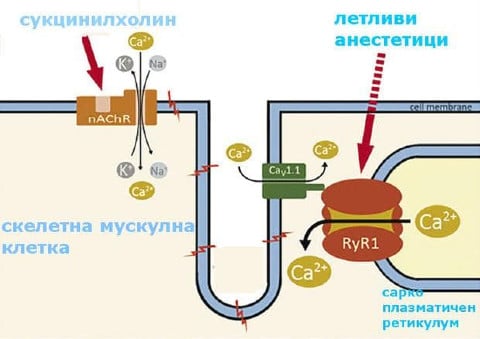
Изображение: http://www.ojrd.com/content/9/1/8
При злокачествена хипертермия са налице генетични промени (мутации) на рианодиновите или дихидропиридиновите рецептори (тоест саркоплазмените калциеви йонни канали). Чрез постъпване на отключващи вещества, при предразположени пациенти се задейства масивно и неконтролирано отделяне на калций в мускулните клетки. Това активира мускулните влакна. Тъй като както повторното поемане на калций в саркоплазмения ретикулум, така и разтварянето на съкратителните нишки след свиването са енергийно зависими процеси, които изискват АТФ, клетката бързо страда от липса на енергия. Калциевите йони водят до силно увеличаване на клетъчния метаболизъм (аеробно производство на енергия, по-късно и анаеробен метаболизъм), което води до увеличен кислороден обмен (и следователно консумация) и увеличено производство на въглероден диоксид и топлина. Тези процеси първоначално протичат изолирано в скелетната мускулатура. В хода на заболяването мускулните контракции до ригидност, клетъчна смърт и мускулен разпад (рабдомиолиза) водят до липса на кислород (хипоксия), повишено натрупване на въглероден диоксид (хиперкапния) и тежка ацидоза с лактатна ацидоза или лактатемия (поради анаеробна гликолиза) и прегряване (хипертермия) в цялото тяло. Това има (вторичен) увреждащ ефект върху други органи. Не е ясно дали генетичните промени играят роля и в други органи в допълнение към скелетните мускули и водят ли до нарушения там. Сърдечните мускули не са засегнати от мутациите в рианодиновия рецептор.
Клинична картина
Клиничните симптоми на злокачествена хипертермия, дължаща се на анестезия са силно променливи и варират с леки или умерени симптоми до фулминантни кризи с тежък хиперметаболизъм на скелетната мускулатура и рабдомиолиза. Прекомерното производство на въглероден диоксид, което се проявява с увеличаване на крайната приливна концентрация на CO2 или хипервентилация при спонтанно дишане, е чувствителен и специфичен ранен признак. Внезапно повишаване на крайния прилив на CO2 може да настъпи едновременно с приложението на сукцинилхолин. 50–80% от пациентите развиват аритмия или мускулни реакции. Неспецифичната синусова тахикардия може да бъде погрешно интерпретирана като неадекватна анестезия, което често забавя диагностицирането на злокачествената хипертермия. Отличителна цианоза, показваща повишена консумация на кислород, може да се появи по-късно в хода на епизода. Бързото повишаване на температурата (над 38,8 °C) е относително късен знак. Бързото повишаване на телесната температура с повече от 1 °C за 15 минути е диагностично по-подходящо от пиковата температура. В някои случаи няма значими промени в телесната температура, особено ако адекватното лечение започне рано. Артериална анализите на кръвни газове разкриват комбинация от дихателна и метаболитна ацидоза с отрицателен излишък на бази, лактемия, хиперкапния и хипоксемия. Фулминантната криза обикновено се проявява със стойности на парциално налягане на CO2 над 60 mmHg и излишък на бази над 8 mVal/литър. С напредването на епизода рабдомиолизата води до хиперкалиемия, повишена креатин фосфокиназа и миоглобинемия и може да доведе до остра бъбречна недостатъчност. Крайният етап на фулминантна криза се характеризира с полиорганна недостатъчност и колапс на кръвообращението.
Диагноза
Злокачествената хипертермия се диагностицира на клинична основа, но различни лабораторни изследвания могат да се окажат потвърдителни. Те включват:
- повишено ниво на креатин киназата
- повишена калий
- повишен фосфат (водещо до намаляване на калций)
- завишен миоглобин (резултат от увреждане на мускулните клетки).
Тежка рабдомиолиза може да доведе до остра бъбречна недостатъчност, така че бъбречната функция трябва да се следи. Пациентите могат да получат преждевременни камерни съкращения поради повишените нива на калий.
Критерии за определяне на тежестта на злокачествена хипертермия, дължаща се на анестезия са:
- респираторна ацидоза – нива на СО2 над 60 mmHg
- необяснима синусова тахикардия, камерна тахикардия или камерно мъждене
- метаболитна ацидоза (ВЕ под — 8, рН под 7,25)
- мускулна ригидност
- мускулен разпад (креатин киназа над 20,000/л единици, урина с цвят на кола, излишък на миоглобин в урина или серум, калий над 6 ммол/л)
- бързо повишаване на телесната температура над 38,8 °C
- бързо повлияване от дантролен
- фамилна анамнеза
За всеки критерий се дава по една точка и накрая се събират всичките точки. Колкото по-висока е оценката, толкова по-вероятно е да става въпрос за злокачествена хипертермия.
Тестове за чувствителност
Основните кандидати за тестване са тези с близък роднина, който е претърпял епизод на злокачествена хипертермия или е доказано, че е податлив. Стандартната процедура е "тест за контрактура на кофеин-халотан". Мускулната биопсия се извършва в одобрен изследователски център под местна упойка. Прясната биопсия се "къпе" в разтвори, съдържащи кофеин или халотан и се наблюдава за свиване. При добри условия чувствителността е 97%, а специфичността 78%. Отрицателните биопсии не са окончателни, така че всеки пациент, който е подозиран за злокачествена хипертермия от медицинската си история или тази на кръвни роднини, обикновено се лекува с недействащи анестетици, дори ако биопсията е отрицателна. Някои изследователи препоръчват използването на теста за "освобождаване на калций, предизвикан от калций" в допълнение към "теста за контрактура на кофеин-халотан", за да направи теста по-специфичен.
Предложени са по-малко инвазивни диагностични техники. Доказано е, че интрамускулното инжектиране на халотан 6 обемни % Води до повишаване на локалното налягане на въглероден диоксид над нормалното сред пациентите с известна чувствителност към злокачествена хипертермия. Чувствителността е 100%, а специфичността е 75%. За пациенти с риск, подобен на този в това проучване, това води до положителна прогнозна стойност от 80% и отрицателна прогнозна стойност от 100%. Този метод може да осигури подходяща алтернатива на по-инвазивните техники. Изследване от 2002 година изследва друг възможен метаболитен тест. В този тест интрамускулното инжектиране на кофеин е последвано от локално измерване на налягането на въглероден диоксид. Тези с известна чувствителност към злокачествена хипертермия са имали значително по-висок налягане на въглероден диоксид (63 срещу 44 mmHg). Авторите предлагат по-големи проучвания за оценка на пригодността на теста за определяне на риска от злокачествена хипертермия.
Генетично тестване
Генетичните тестове се извършват по ограничен начин, за да се определи чувствителността към злокачествена хипертермия. При хора с фамилна анамнеза за злокачествена хипертермия, анализът за RYR1 мутации може да бъде полезен.
Лечение
Показанията за лечение на злокачествена хипертермия с дантролен включват признаци на хиперметаболизъм, бързо покачване на въглеродния диоксид при увеличаване на минутната вентилация, тахикардия, мускулна и челюстна ригидност (след сукцинилхолин) и треска (късен знак).
Не всички тези показания са налице при всички пациенти. Ако се появи остра реакция, най-добре е незабавното включване на дантролен, вместо да се чака твърде дълго и това да доведе до лош резултат. Колкото по-дълго се чака преди започване на терапията, толкова по-малка е вероятността за пълно възстановяване.
Изображение: Gene Hobbs, CC BY-SA 4.0
Фулминантната, бързо прогресираща злокачествена хипертермия изисква ранна диагностика и ранно бързо приложение на дантролен, спиране на отключващите агенти и помощ от допълнителен персонал. Хирургът трябва да бъде уведомен незабавно и да спре процедурата възможно най-скоро.
Желателно е охлаждане и ранно лечение на хиперкалиемия. Блокерите на калциевите канали трябва да се избягват, ако се използва дантролен, тъй като те могат да причинят хиперкалиемия.
Дантроленът е производно на хидантоин, което директно пречи на мускулната контракция, като инхибира освобождаването на калциеви йони от саркоплазматичния ретикулум, вероятно чрез свързване с рианодинови рецептори тип 1 (RYR-1). Началната доза е 2,5 милиграма/килограм тегло, повтаря се на всеки 5 минути, докато настъпи обрат на реакцията или се достигне обща доза от 10 милиграма/килограм (или 20 милиграма/килограм, според някои специалисти). Ако няма клиничен отговор, трябва да се обмисли друга диагноза.
Дантроленът също ще понижи повишената температура при разстройства, различни от злокачествена хипертермия, като буря на щитовидната жлеза, злокачествен невролептичен синдром и сепсис. Полуживотът му е 6-10 часа.
След като се контролира първоначалната реакция, се препоръчва непрекъснато наблюдение в отделението за интензивно лечение в продължение на 24-48 часа, заедно с приложението на дантролен (1 милиграм/килограм тегло на всеки 4-6 часа или еквивалентно количество, давано като непрекъсната инфузия). Миоглобинурията трябва да се наблюдава и да се лекува с течности и диуретици, ако се появи. Нивото на креатин киназата ще достигне своя връх около 8-10 часа след събитието и трябва да се проследява, докато се върне към нормалното.
Прогнозата е лоша, ако не се реагира бързо и не се приложи своевременно лечение. Към днешна дата смъртността е по-малка от 5%.
Заглавно изображение: freepik.com
Симптоми и признаци при Злокачествена хипертермия, дължаща се на анестезия МКБ T88.3
- Мускулна слабост
- Симптоми на челюстта
- Повишена киселинност на кръвта в резултат на метаболитни нарушения
- Тахикардия
- Мускулна ригидност
- Аритмии
Библиография
https://emedicine.medscape.com/article/2231150-treatment
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4524368/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4027921/
https://en.wikipedia.org/wiki/Malignant_hyperthermia
Коментари към Злокачествена хипертермия, дължаща се на анестезия МКБ T88.3