папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) (papillomavirus (human types 6, 11, 16, 18, 31, 33, 45, 52, 58) ) | ATC J07BM03
papillomavirus (human types 6, 11, 16, 18, 31, 33, 45, 52, 58) | J07BM03
Човешкият папиломен вирус е ДНК вирус, който атакува епителните клетки на кожата и лигавиците на човешкото тяло. Познати са около 200 различни типа, всеки от които се характеризира със специфичност във въздействието си върху тъканите.
Човешките папиломни вируси (HPV) са причинители на една от най-разпространените полово пренасяни вирусни инфекции в света. Известни са около 43 типа HPV, предавани по полов път, от които 18 са с доказан онкогенен потенциал. Други разновидности на вируса се пренасят чрез физически контакт/допир и могат да доведат до формирането на брадавици, лишеи, както и опасни злокачествени кожни образувания. HPV са основен причинител за развитието на рак на маточната шийка. Тази форма се среща по-малко от 1 на милион, уверяват американски учени.
Вирусни типове, които носят нисък риск от прогресиране към рак, са: 6, 11, 42, 43 и 44. Вирусни типове, които са свързани с изключително висок риск от развитие на злокачествено заболяване: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 66.
Показания
Ваксината срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) е ваксина, показана при жени на възраст от 9 до 45 години за профилактика на:
- цервикален, вулварен, вагинален, анален, орофарингеален и други видове рак на главата и шията, причинени от човешки папиломен вирус (HPV) типове 16, 18, 31, 33, 45, 52 и 58
- цервикални, вулварни, вагинални и анални предракови или диспластични лезии, причинени от HPV типове 6, 11, 16, 18, 31, 33, 45, 52 и 58
- генитални брадавици, причинени от HPV типове 6 и 11.
Противопоказания
9-валентната ваксина срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) е противопоказна при индивиди със свръхчувствителност, включително тежки алергични реакции към дрожди, или след предишна доза.
Тъй като ваксинираните могат да развият синкоп, понякога водещ до падане с нараняване, се препоръчва наблюдение в продължение на 15 минути след приложението. Съобщава се за синкоп, понякога свързан с тонично-клонични движения и друга активност, подобна на гърчове, след HPV ваксинация. Когато синкопът е свързан с тонично-клонични движения, активността обикновено е преходна и обикновено отговаря на възстановяване на церебралната перфузия.
Безопасността и ефективността на ваксината не са установени при бременни жени.
Специални предупреждения и предпазни мерки при употреба
Както при всички инжекционни ваксини, винаги следва да има готовност за съответно медицинско лечение и наблюдение в случай на редки анафилактични реакции след прилагане на ваксината.
Особено при юноши, след ваксиниране, а дори и преди това, може да настъпи синкоп (припадък), понякога свързан с падане, като психогенен отговор към инжекцията с игла. Това може да бъде придружено от определени неврологични признаци, като преходно зрително смущение, парестезия и тонично-клонични движения на крайниците по време на възстановяването. Затова е необходимо наблюдение за около 15 минути след имунизация.
Важно е да съществуват процедури за избягване на нараняване вследствие на припадък. Имунизацията трябва да се отложи при хора, които имат остро, тежко фебрилно заболяване. В същото време, наличието на лека инфекция, като лека форма на инфекция на горните дихателни пътища или леко повишена температура, не представлява противопоказание за имунизиране.
Ваксината е само за профилактично приложение и няма ефект върху НРV инфекции или развито клинично заболяване. Ваксината не е демонстрирала терапевтичен ефект. Поради това ваксината не е показана за лечение на цервикален, вулварен, вагинален и анален карцином, високостепенни цервикални, вулварни, вагинални и анални диспластични лезии или генитални кондиломи. Освен това, не е предназначена за предотвратяване прогресирането на други доказано HPV-свързани лезии.
Ваксината не предотвратява лезии, причинени от ваксинален HPV тип при лица, които са инфектирани с този HPV тип в момента на имунизацията. Имунизацията не замества рутинния цервикален скрининг. Тъй като няма ваксина, която да е 100 % ефективна и не осигурява защита срещу всеки HPV тип или срещу HPV инфекции, съществуващи към момента на имунизацията, рутинното цервикално скриниране остава от критично значение и трябва да се осъществява в съответствие с местните препоръки.
Лицата с нарушена имунна реактивност, дължаща се на прилагането на мощно имуносупресивно лечение, генетичен дефект, инфекция с човешки имунодефицитен вирус (HIV) или други причини, може да не отговорят на ваксината. Тази ваксина трябва да се прилага с повишено внимание при лица с тромбоцитопения или някакво нарушение на кръвосъсирването, тъй като при интрамускулно приложение при тези лица може да се получи кървене.
Бременност и кърмене
Голям обем данни за бременни жени (за изхода на повече от 1 000 случая на бременност) не показват малформативна или фетална/неонатална токсичност на ваксината. Проучванията при животни не показват репродуктивна токсичност. Тези данни обаче се считат за недостатъчни, за да се препоръча използването по време на бременност. Ваксинирането трябва да се отложи до приключване на бременността.
Ваксината срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) може да се използва по време на кърмене.
Лекарствени взаимодействия
Безопасността и имуногенността при лица, получили имуноглобулин или продукти, получени от кръв, 3 месеца преди имунизация, не са проучени в клинични изпитвания.
Ваксината може да се прилага съпътстващо с комбинирана бустер ваксина срещу дифтерия и тетанус, както и с коклюш (безклетъчна, компонентна) и/или полиомиелит (инактивиран), без значимо повлияване на антитяло-отговора към някой от компонентите на всяка от ваксините.
При клинични проучвания 60,2 % от жените на възраст 16 до 26 години, които са получили ваксина срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58), използват хормонални контрацептиви през периода на имунизиация в клиничните проучвания.
Нежелани реакции
При прилагането на ваксина срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) могат да се наблюдават следните странични реакции:
- болка на мястото на инжектиране
- оток на мястото на инжектиране
- еритема на мястото на инжектиране
- главоболие
- пирексия
Предозиране
Няма съобщени случаи на предозиране.
Фармакологични характеристики
Ваксината срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) е адювантна неинфекциозна, рекомбинантна, 9-валентна ваксина. Тя е приготвена от високопречистени вирусоподобни частици (virus-like particles, VLPs) от основния капсид L1 протеин на четири HPV типа (6, 11, 16, 18), същите като в qHPV ваксината, и на 5 допълнителни HPV типа (31, 33, 45, 52, 58). Тя съдържа същия аморфен алуминиев хидроксифосфат сулфат адювант като qHPV ваксината. VLPs не могат да инфектират клетки, да се възпроизвеждат или да причиняват заболяване. Счита се, че ефикасността на LI VLP ваксините се медиира от развитието на хуморален имунен отговор. Включените във ваксината генотипове HPV 6, 11, 16, 18, 31, 33, 45, 52, 58 ще бъдат наричани ваксинални HPV типове.
Въз основа на епидемиологични проучвания се очаква Gardasil 9 да предпазва от HPV типове, които причиняват приблизително: 90 % от случаите на цервикален карцином, над 95 % от случаите на аденокарцином in situ (adenocarcinoma in situ - AIS), 75-85 % от случаите на високостепенна цервикална интраепителна неоплазия (cervical intraepithelial neoplasia, CIN 2/3), 85-90 % от свързаните с HPV случаи на вулварен карцином, 90-95 % от свързаните с HPV случаи на високостепенна вулварна интраепителна неоплазия (vulvar intraepithelial neoplasia, VIN 2/3), 80-85 % от свързан с HPV вагинален карцином, 75-85 % от свързаните с HPV случаи на високостепенна вагинална интраепителна неоплазия (vaginal intraepithelial neoplasia, VaIN 2/3), 90-95 % от свързан с HPV анален карцином, 85-90 % от свързаните с HPV случаи на високостепенна анална интраепителна неоплазия (anal intraepithelial neoplasia, AIN 2/3) и 90 % от гениталните кондиломи.
Дозировка
Ваксината трябва да се прилага като интрамускулна инжекция. Предпочитаното място е делтоидната област в горната част на мишницата или горната предно-латерална област на бедрото. Ваксината не трябва да се инжектира вътресъдово, подкожно или интрадермално. Ваксината не трябва да се смесва в една и съща спринцовка, с каквито и да е други ваксини и разтвор.
Лица на възраст от 9 до 14 години включително към момента на първото инжектиране може да се прилага по 2-дозова схема (0, 6 – 12 месеца). Втората доза трябва да се постави между 5 и 13 месеца след първата доза. Ако втората доза се постави по-рано от 5 месеца след първата, винаги трябва да се поставя и трета доза.
Ваксината срещу папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) може да се приложи по 3-дозова схема (0, 2, 6 месеца). Втората доза трябва да се приложи не по-рано от един месец след първата, а третата доза трябва да се приложи не по-рано от 3 месеца след втората. Трите дози трябва да се приложат в рамките на период от 1 година.
При лица на възраст 15 години и по-големи към момента на първото инжектиране ваксината трябва да се прилага по 3-дозова схема (0, 2, 6 месеца). Втората доза трябва да се приложи не по-рано от един месец след първата, а третата доза трябва да се приложи не по-рано от 3 месеца след втората. Трите дози трябва да се приложат в рамките на период от 1 година.
Заглавно изображение: framar.bg
Продукти свързани с папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58)
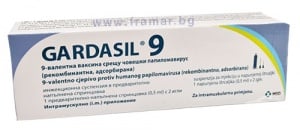
ГАРДАЗИЛ 9 инжекционна суспензия в предварително напълнена спринцовка 0.5 мл с 2 игли
ТермолабилниБиблиография
https://www.merckvaccines.com/gardasil9/
https://www.fda.gov/vaccines-blood-biologics/vaccines/gardasil-9
https://reference.medscape.com/drug/gardasil-9-human-papillomavirus-vaccine-nonavalent-999976#4
https://www.cdc.gov/hpv/hcp/schedules-recommendations.html
Коментари към папиломавирус (човешки тип 6, 11, 16, 18, 31, 33, 45, 52, 58) (papillomavirus (human types 6, 11, 16, 18, 31, 33, 45, 52, 58) ) | ATC J07BM03